解答题-原理综合题 适中0.65 引用1 组卷39
(1)能源是影响全球经济和生活的首要因素。已知下列热化学方程式:
①H2(g)+
②H2O(g)=H2(g) +
③C(s)+
④C(s)+ O2(g)=CO2(g) △H =-393.5 kJ / mol
如果完全燃烧2 g H2生成液态水,那么放出的热量为
(2)一定条件下,反应N2(g)+3H2(g)
(3)25℃时,有浓度均为0.10 mol/L的乙酸、乙酸钠两种溶液。请回答:两种溶液中,c(H+) <c(OH-)的是
21-22高二上·辽宁沈阳·阶段练习
类题推荐
(1)将碳与水蒸气在高温下反应制得水煤气。水煤气的主要成分是CO和H2,两者的体积比约为l:l。已知:C(s)+ O2(g)=CO(g) △H=-111.0 kJ·mol-1;
O2(g)=CO(g) △H=-111.0 kJ·mol-1;
H2(g)+ O2(g)=H2O(g) △H=-242.0 kJ·mol-1。
O2(g)=H2O(g) △H=-242.0 kJ·mol-1。
写出由C(s)与H2O(g)反应生成水煤气的热化学方程式:_________________ 。
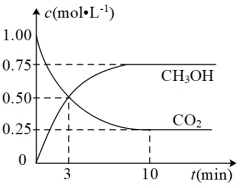
(2)为减弱温室效应,有一种思路是将CO2转化成其它可燃物质。工业上已实现CO2和H2反应生成甲醇的转化。已知:在一体积恒定为1L的恒温密闭容器中充入l mol CO2和3 mol H2,一定条件下发生反应:CO2(g) + 3H2(g) CH3OH(g) + H2O(g) △H= -50.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如右图所示。请回答:
CH3OH(g) + H2O(g) △H= -50.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如右图所示。请回答:
① 反应进行到10min时放出的热量为_________ 。
② 在前10min内,用H2浓度的变化表示的反应速率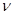 (H2)=
(H2)=________ mol·L-1·min-1。
③能判断该反应达到化学平衡状态的依据是___________ 。
E.混合气体的密度不变
F.混合气体的平均相对分子质量不变
④该反应平衡常数的表达式为________________ 。
⑤反应达到平衡后,若往平衡体系中再加入1mol CO2、3mol H2并达到新的平衡,与原平衡相比,CO2的物质的量浓度___________ (填“增大”“不变”或“减小”,下同),H2的转化率_____________ 。
H2(g)+
写出由C(s)与H2O(g)反应生成水煤气的热化学方程式:
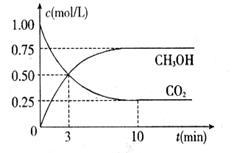
(2)为减弱温室效应,有一种思路是将CO2转化成其它可燃物质。工业上已实现CO2和H2反应生成甲醇的转化。已知:在一体积恒定为1L的恒温密闭容器中充入l mol CO2和3 mol H2,一定条件下发生反应:CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g) △H= -50.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如右图所示。请回答:
CH3OH(g) + H2O(g) △H= -50.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如右图所示。请回答:
① 反应进行到10min时放出的热量为
② 在前10min内,用H2浓度的变化表示的反应速率
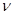 (H2)=
(H2)=③能判断该反应达到化学平衡状态的依据是
| A.容器压强不变 |
| B.混合气体中c(CO2)不变 |
C.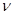 (CH3OH)= (CH3OH)= 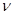 (H2O) (H2O) |
| D.c(CH3OH)=c(H2O) |
E.混合气体的密度不变
F.混合气体的平均相对分子质量不变
④该反应平衡常数的表达式为
⑤反应达到平衡后,若往平衡体系中再加入1mol CO2、3mol H2并达到新的平衡,与原平衡相比,CO2的物质的量浓度
(1)在一定条件下N2与H2反应生成NH3,请回答:
①若反应物的总能量为E1,生成物的总能量为E2,且E1>E2,则该反应为___________ (填“吸热”或“放热”)反应。
②已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为___________ 。
(2) N2H4和H2O2混合可作火箭推进剂,已知:16 g液态N2H4和足量氧气反应生成N2(g)和H2O(l),放出310.6 kJ的热量;2H2O2(l)=O2(g)+2H2O(l) ΔH=-196.4 kJ·mol-1.反应N2H4(g)+O2(g)=N2(g)+2H2O(l)的ΔH=___________ kJ·mol-1.N2H4和H2O2反应生成N2(g)和H2O(l)的热化学方程式为___________ 。
(3)向2L的 密闭容器中加入足量的活性炭和2.0molNO,发生反应C(s)+2NO(g) N2 (g)+CO2(g) ΔH=-574.5kJ / mol,NO和N2的物质的量变化如下表所示:
N2 (g)+CO2(g) ΔH=-574.5kJ / mol,NO和N2的物质的量变化如下表所示:
①0到5min中之内,用NO表示的化学反应速率为___________ mol/l,该条件下平衡常数K=___________ ;
②第15min后,温度调整到T2,则T1___________ T2(填“>”,“<”或者“=”)
③若30min时,温度保持T2不变,,向该反应中再加入该四种反应混合物各2.0mol,此时反应___________ (填“正向”,“逆向”或“不”)移动。
①若反应物的总能量为E1,生成物的总能量为E2,且E1>E2,则该反应为
②已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为
(2) N2H4和H2O2混合可作火箭推进剂,已知:16 g液态N2H4和足量氧气反应生成N2(g)和H2O(l),放出310.6 kJ的热量;2H2O2(l)=O2(g)+2H2O(l) ΔH=-196.4 kJ·mol-1.反应N2H4(g)+O2(g)=N2(g)+2H2O(l)的ΔH=
(3)向2L的 密闭容器中加入足量的活性炭和2.0molNO,发生反应C(s)+2NO(g)
| 物质的量浓度(mol/L) | T1/℃ | T2/℃ | |||||
| 0 | 5min | 10min | 15min | 20min | 25min | 30min | |
| NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.25 | 0.20 | 0.20 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.375 | 0.40 | 0.40 |
①0到5min中之内,用NO表示的化学反应速率为
②第15min后,温度调整到T2,则T1
③若30min时,温度保持T2不变,,向该反应中再加入该四种反应混合物各2.0mol,此时反应
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网