解答题-原理综合题 适中0.65 引用1 组卷53
海洋资源的利用具有广阔前景。
(1)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:

①灼烧海带至灰烬时所用的主要仪器名称是___________ (填序号)
a.坩埚 b.试管 c.蒸发皿 d.烧杯
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式___________ 。
③用CCl4提取碘时除了用CCl4还可以选用的试剂是___________ (填字母序号)
a.苯 b.乙醇 c.乙酸
④为检验用CCl4提取碘后的水溶液中是否还含有碘单质。请写出该实验的实验步骤、现象及结论:___________ 。
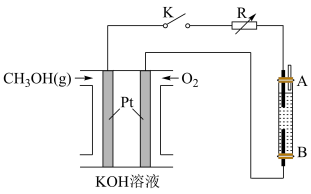
(2)利用海底的“可燃冰”制作的燃料电池的总反应式为CH4+2O2+2KOH=K2CO3+3H2O,则该燃料电池的负极的电极反应为___________ 。
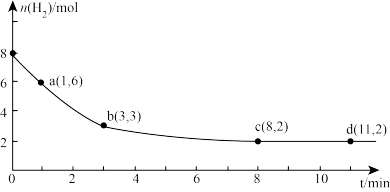
(3)海底的煤经综合利用开发的副产物CO2能生产甲醇燃料,其反应的方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。某科学实验将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。a、b、c、d括号内数据表示坐标。
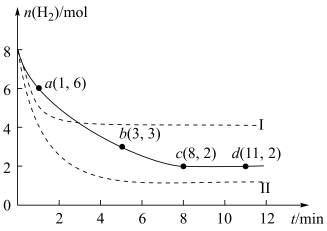
①a点正反应速率___________ (填“大于”“等于”或“小于”)a点逆反应速率。
②平衡时CO2的物质的量浓度是___________ mol/L。
③能够说明该反应达到化学平衡状态的标志是___________ (双选)。
A.单位时间内消耗1 mol CO2,同时生成3 mol H2 B.混合气体的密度不随时间变化
C.CH3OH、H2的浓度不再随时间变化 D.CH3OH和H2O浓度相等
(1)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:

①灼烧海带至灰烬时所用的主要仪器名称是
a.坩埚 b.试管 c.蒸发皿 d.烧杯
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式
③用CCl4提取碘时除了用CCl4还可以选用的试剂是
a.苯 b.乙醇 c.乙酸
④为检验用CCl4提取碘后的水溶液中是否还含有碘单质。请写出该实验的实验步骤、现象及结论:
(2)利用海底的“可燃冰”制作的燃料电池的总反应式为CH4+2O2+2KOH=K2CO3+3H2O,则该燃料电池的负极的电极反应为
(3)海底的煤经综合利用开发的副产物CO2能生产甲醇燃料,其反应的方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。某科学实验将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。a、b、c、d括号内数据表示坐标。

①a点正反应速率
②平衡时CO2的物质的量浓度是
③能够说明该反应达到化学平衡状态的标志是
A.单位时间内消耗1 mol CO2,同时生成3 mol H2 B.混合气体的密度不随时间变化
C.CH3OH、H2的浓度不再随时间变化 D.CH3OH和H2O浓度相等
21-22高二上·甘肃平凉·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网