解答题-实验探究题 适中0.65 引用1 组卷116
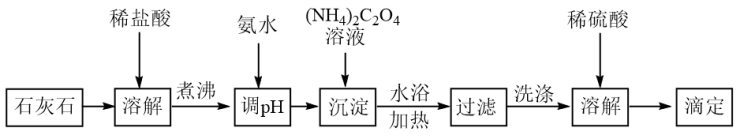
天然石灰石是工业生产中重要的原材料之一,它的主要成分是CaCO3,一般以CaO的质量分数表示钙含量,常采用高锰酸钾法测定。步骤如下:
I.称取ag研细的石灰石样品于250mL烧杯中,加过量稀盐酸溶解,水浴加热10分钟;
II.稍冷后逐滴加入氨水至溶液pH≈4,再缓慢加入适量(NH4)2C2O4溶液,继续水浴加热30分钟;
III.冷却至室温后过滤出沉淀,用另外配制的稀(NH4)2C2O4溶液洗涤沉淀三次,再用蒸馏水洗涤至洗涤液中无法检出Cl−;
IV.加入适量热的稀硫酸至沉淀中,获得的溶液用cmol·L−1KMnO4标准溶液滴定至终点。
V.平行测定三次,消耗KMnO4溶液的体积平均为VmL。
已知:H2C2O4是弱酸;CaC2O4是难溶于水的白色沉淀。
(1)I中为了加快反应速率而采取的操作有___________ 。
(2)II中加入氨水调节溶液pH的作用是___________ 。
(3)III中洗涤得到干净的沉淀。
①结合平衡移动原理,解释用稀(NH4)2C2O4溶液洗涤沉淀的目的___________ 。
②验证沉淀是否洗涤干净的操作是___________ 。
③若沉淀中的Cl−未洗涤干净,则最终测量结果___________ (填“偏大”、“偏小”或“不变”)。
(4)IV中用KMnO4标准溶液滴定。
①滴定时发生反应的离子方程式为___________ 。
②滴定至终点的现象为___________ 。
③样品中以CaO质量分数表示的钙含量为___________ (列出表达式)。
I.称取ag研细的石灰石样品于250mL烧杯中,加过量稀盐酸溶解,水浴加热10分钟;
II.稍冷后逐滴加入氨水至溶液pH≈4,再缓慢加入适量(NH4)2C2O4溶液,继续水浴加热30分钟;
III.冷却至室温后过滤出沉淀,用另外配制的稀(NH4)2C2O4溶液洗涤沉淀三次,再用蒸馏水洗涤至洗涤液中无法检出Cl−;
IV.加入适量热的稀硫酸至沉淀中,获得的溶液用cmol·L−1KMnO4标准溶液滴定至终点。
V.平行测定三次,消耗KMnO4溶液的体积平均为VmL。
已知:H2C2O4是弱酸;CaC2O4是难溶于水的白色沉淀。
(1)I中为了加快反应速率而采取的操作有
(2)II中加入氨水调节溶液pH的作用是
(3)III中洗涤得到干净的沉淀。
①结合平衡移动原理,解释用稀(NH4)2C2O4溶液洗涤沉淀的目的
②验证沉淀是否洗涤干净的操作是
③若沉淀中的Cl−未洗涤干净,则最终测量结果
(4)IV中用KMnO4标准溶液滴定。
①滴定时发生反应的离子方程式为
②滴定至终点的现象为
③样品中以CaO质量分数表示的钙含量为
21-22高三上·内蒙古赤峰·阶段练习
类题推荐
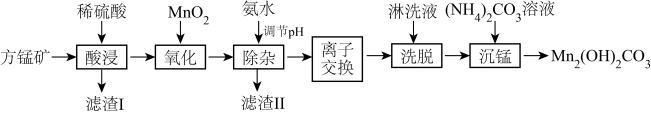
碱式碳酸锰[Mn2(OH)2CO3]是一种不溶于水的固体,是制造其他含锰化合物的原料。工业上以方锰矿(主要成分为 MnO,还含有少量的 Fe3O4、Al2O3、CaO、SiO2)为原料制备碱式碳酸锰。
回答下列问题:
(1)“酸浸”时,滤渣I的成分是___________ (填化学式)。
(2)“氧化”时,该反应的离子方程式为___________ 。
(3)“除杂”时,使用氨水的目的是将 Fe3+和Al3+转化为沉淀而除去,则应调节溶液的pH≥______ ;若 A13+沉淀完全时,则溶液中 Fe3+的物质的量浓度为___________ mol·L-1(通常认为溶液中的离子浓度≤1×10-5mol·L-1沉淀完全)
(4)“离子交换”和“洗脱”时,发生反应:Mn2+ +2HR MnR2 +2H+(HR 是氢型交换树脂)。洗脱为了提高“洗脱”效率,淋洗液应为
MnR2 +2H+(HR 是氢型交换树脂)。洗脱为了提高“洗脱”效率,淋洗液应为___________ (填“硫酸”、“氢氧化钠溶液”或“蒸馏水”)。
(5)“沉锰”时,反应的离子方程式为___________ ,过滤、洗涤、干燥,得到Mn2(OH)2CO3,检验沉淀是否洗涤干净的操作是___________ 。
(6)为测定产品中锰的含量,取 a g 样品于烧杯中,加水溶解,加入足量的稀硫酸溶解,滴加过量的 0.1000 mol·L-1(NH4)2S2O8溶液将锰元素转化为 MnO ,充分反应后加热一段时间,冷却将烧杯中的溶液全部转移至 250mL 容量瓶中。取 25.00mL 于锥形瓶中,用0.1000mol·L-1FeSO4标准溶液滴定,达滴定终点时,消耗 FeSO4溶液的体积为 V mL。
,充分反应后加热一段时间,冷却将烧杯中的溶液全部转移至 250mL 容量瓶中。取 25.00mL 于锥形瓶中,用0.1000mol·L-1FeSO4标准溶液滴定,达滴定终点时,消耗 FeSO4溶液的体积为 V mL。
①滴定终点的现象是___________ 。
②该产品中锰的质量分数为___________ 。(用含 a、V 的式子表示)。
| 物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ca(OH)2 |
| Ksp | 2×10-13 | 5×10-17 | 3×10-39 | 1×10-32 | 6×10-6 |
(1)“酸浸”时,滤渣I的成分是
(2)“氧化”时,该反应的离子方程式为
(3)“除杂”时,使用氨水的目的是将 Fe3+和Al3+转化为沉淀而除去,则应调节溶液的pH≥
(4)“离子交换”和“洗脱”时,发生反应:Mn2+ +2HR
(5)“沉锰”时,反应的离子方程式为
(6)为测定产品中锰的含量,取 a g 样品于烧杯中,加水溶解,加入足量的稀硫酸溶解,滴加过量的 0.1000 mol·L-1(NH4)2S2O8溶液将锰元素转化为 MnO
①滴定终点的现象是
②该产品中锰的质量分数为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网