填空题 适中0.65 引用1 组卷123
能源是人类社会发展不可或缺的基本条件,社会的可持续发展离不开各种能源的合理开发使用和治理。化石能源的使用也产生了很多环境问题,如二氧化碳的过度排放等。因此我国计划在2030年实现“碳达峰”,体现了对解决全球环境问题的大国担当。
(1)甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2=2CO+2H2.1 g CH4完全反应可释放15.46 kJ的热量,能表示该反应过程中能量变化的是___________ (填字母)。请列举除氢能源外的两种新能源___________ 。
A.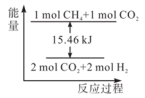 B.
B.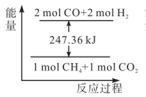 C.
C.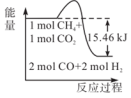 D.
D.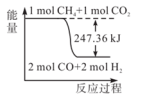
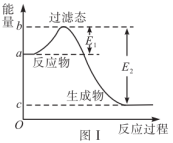
(2)图I是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是___________ (填“增大”“减小”或“不变”),∆H的变化是___________ (填“增大”“减小”或“不变”)。
(3)已知反应2NO(g)+2H2(g) N2(g)+2H2O(g) ∆H=-752 kJ/mol的反应机理如下:
N2(g)+2H2O(g) ∆H=-752 kJ/mol的反应机理如下:
①2NO(g) N2O2(g)(快)
N2O2(g)(快)
②N2O2(g)+H2(g) N2O(g)+H2O(g)(慢)
N2O(g)+H2O(g)(慢)
③N2O(g)+H2(g) N2(g)+H2O(g)(快)
N2(g)+H2O(g)(快)
请比较:反应②的活化能___________ (填“大于”或“小于”)反应③的的活化能。
(4)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
①2NH3(l)+H2O(l)+CO2(g)=(NH4)2CO3(aq) ∆H1
②NH3(l)+H2O(l)+CO2(g)=NH4HCO3(aq) ∆H2
③(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq) ∆H3
∆H3和∆H1、∆H2之间的关系是∆H3=___________ 。
(1)甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2=2CO+2H2.1 g CH4完全反应可释放15.46 kJ的热量,能表示该反应过程中能量变化的是
A.
 B.
B. C.
C. D.
D.
(2)图I是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是

(3)已知反应2NO(g)+2H2(g)
①2NO(g)
②N2O2(g)+H2(g)
③N2O(g)+H2(g)
请比较:反应②的活化能
(4)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
①2NH3(l)+H2O(l)+CO2(g)=(NH4)2CO3(aq) ∆H1
②NH3(l)+H2O(l)+CO2(g)=NH4HCO3(aq) ∆H2
③(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq) ∆H3
∆H3和∆H1、∆H2之间的关系是∆H3=
21-22高二上·安徽·阶段练习
类题推荐
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用。
(1)如图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:_______ 。加入催化剂E1________ (填“增大”、“减小”或“不变”)。

(2)若已知下列数据:
试根据表中及图中数据计算N—H的键能:_______ kJ·mol−1。
(3)捕碳技术(主要指捕获CO2在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)=(NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)=NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq) ΔH3
请回答下列问题:
ΔH3与ΔH1、ΔH2之间的关系是ΔH3=________ 。
(4)试比较下列两组ΔH的大小(填“>”、“<”或“=”)
①H2(g)+ O2(g)=H2O(g) ΔH1;H2(g)+
O2(g)=H2O(g) ΔH1;H2(g)+ O2(g)=H2O(l) ΔH2;则ΔH1
O2(g)=H2O(l) ΔH2;则ΔH1____ ΔH2。
②S(s)+O2(g)=SO2(g) ΔH3;Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(s)+10H2O(l)+2NH3(g) ΔH4;则ΔH3_____ ΔH4。
(1)如图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:

(2)若已知下列数据:
| 化学键 | H—H | N≡N |
| 键能/kJ·mol-1 | 435 | 943 |
(3)捕碳技术(主要指捕获CO2在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)=(NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)=NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq) ΔH3
请回答下列问题:
ΔH3与ΔH1、ΔH2之间的关系是ΔH3=
(4)试比较下列两组ΔH的大小(填“>”、“<”或“=”)
①H2(g)+
②S(s)+O2(g)=SO2(g) ΔH3;Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(s)+10H2O(l)+2NH3(g) ΔH4;则ΔH3
I.合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g) 2NH3(g)△H,合成氨反应在催化剂作用下的反应历程为(*表示吸附态):
2NH3(g)△H,合成氨反应在催化剂作用下的反应历程为(*表示吸附态):
第一步N2(g)→2N*;H2(g)→2H*(慢反应)
第二步N*+H*=NH*;NH*+H*=NH2*;NH2*+H*=NH3*(快反应)
第三步NH3*=NH3(g)(快反应)
比较第一步反应的活化能E1与第二步反应的活化能E2的大小:E1_____ E2(填“>”“<"或“=")。
II.(1)如图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:________ 。

(2)若已知下列数据:
试根据表中及图中数据计算N—H键的键能:___________ kJ·mol-1。
(3)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)=(NH4)2CO3(aq)ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)=NH4HCO3(aq)ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq)ΔH3
则ΔH3与ΔH1、ΔH2之间的关系是ΔH3=_________________
第一步N2(g)→2N*;H2(g)→2H*(慢反应)
第二步N*+H*=NH*;NH*+H*=NH2*;NH2*+H*=NH3*(快反应)
第三步NH3*=NH3(g)(快反应)
比较第一步反应的活化能E1与第二步反应的活化能E2的大小:E1
II.(1)如图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:

(2)若已知下列数据:
| 化学键 | H—H | N≡N |
| 键能/kJ·mol-1 | 435 | 943 |
(3)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)=(NH4)2CO3(aq)ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)=NH4HCO3(aq)ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq)ΔH3
则ΔH3与ΔH1、ΔH2之间的关系是ΔH3=
已知E1=134kJ·mol-1、E2=368kJ·mol-1请参考题中图表,按要求填空:
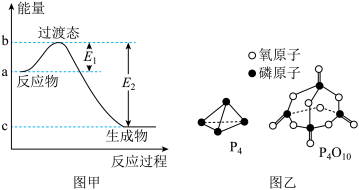
(1)图甲是1mol NO2(g)和1mol CO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,若在反应体系中加入催化剂。反应速率加快,E1的变化是___________ (填“增大”“减小”或“不变”,下同),ΔH的变化是___________ ,请写出NO2和CO反应的热化学方程式:___________ 。
(2)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g) (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g) NH4HCO3(aq) ΔH2
NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g) 2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3
则ΔH3与ΔH1、ΔH2之间的关系是ΔH3=___________ 。
(3)下表所示是部分化学键的键能参数。
已知P4(g)+5O2(g)═P4O10(g) ΔH=-dkJ•mol-1,P4及P4O10的结构如图乙所示。表中x=___________ kJ·mol-1。(用含a、b、c、d的代数式表示)

(1)图甲是1mol NO2(g)和1mol CO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,若在反应体系中加入催化剂。反应速率加快,E1的变化是
(2)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)
则ΔH3与ΔH1、ΔH2之间的关系是ΔH3=
(3)下表所示是部分化学键的键能参数。
| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ·mol-1 | a | b | c | x |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


