解答题-原理综合题 适中0.65 引用3 组卷118
一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g) CH3OH(g)达到平衡状态。
CH3OH(g)达到平衡状态。
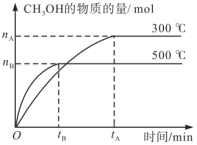
(1)500℃时,从反应开始到化学平衡状态,以H2的浓度变化表示的化学反应速率是___________ mol·L-1·min-1(用nB、tB表示)。
(2)判断该可逆反应达到化学平衡状态的标志是___________ (填字母,下同)。
a.v生成(CH3OH)=v消耗(CO) b.混合气体的平均相对分子质量不再改变
c.混合气体的密度不再改变 d.CH3OH的浓度不再变化
(3)已知CO(g)+2H2(g) CH3OH(g)是放热反应,为了增加甲醇产量,工厂应采取的措施是。
CH3OH(g)是放热反应,为了增加甲醇产量,工厂应采取的措施是。
(4)变量控制方法是研究化学变化规律的重要思想方法。请仔细观察下表中50 mL稀盐酸和1 g碳酸钙反应的实验数据:
分析上述数据,回答下列问题:
①该反应属于___________ 反应(填“吸热”或“放热”)。
②根据实验1、3、4、6可以得出外界条件对反应速率的影响规律是___________ 。
(5)氢能源燃料电池是未来汽车动力的一个重要发展方向,利用2H2+O2=2H2O的燃烧反应,可以构成一个以KOH溶液作电解质溶液的燃料电池,该燃料电池的正极反应式为___________ 。

(1)500℃时,从反应开始到化学平衡状态,以H2的浓度变化表示的化学反应速率是
(2)判断该可逆反应达到化学平衡状态的标志是
a.v生成(CH3OH)=v消耗(CO) b.混合气体的平均相对分子质量不再改变
c.混合气体的密度不再改变 d.CH3OH的浓度不再变化
(3)已知CO(g)+2H2(g)
| A.高温、高压 | B.适宜温度、高压、催化剂 |
| C.低温、低压 | D.低温、高压、催化剂 |
| 实验序号 | 碳酸钙状态 | c(HCl)/(mol/L) | 溶液温度/℃ | 碳酸钙消失所用的时间/s | |
| 反应前 | 反应后 | ||||
| 1 | 粒状 | 0.5 | 20 | 39 | 400 |
| 2 | 粉末 | 0.5 | 20 | 40 | 60 |
| 3 | 粒状 | 0.6 | 20 | 41 | 280 |
| 4 | 粒状 | 0.8 | 20 | 40 | 200 |
| 5 | 粉末 | 0.8 | 20 | 40 | 30 |
| 6 | 粒状 | 1.0 | 20 | 40 | 120 |
| 7 | 粒状 | 1.0 | 30 | 50 | 40 |
分析上述数据,回答下列问题:
①该反应属于
②根据实验1、3、4、6可以得出外界条件对反应速率的影响规律是
(5)氢能源燃料电池是未来汽车动力的一个重要发展方向,利用2H2+O2=2H2O的燃烧反应,可以构成一个以KOH溶液作电解质溶液的燃料电池,该燃料电池的正极反应式为
21-22高二上·安徽·阶段练习
类题推荐
能源、环境与生产生活和社会发展密切相关。
(1)工业上利用CO和H2在催化剂作用下合成甲醇:CO(g)+2H2(g) ⇌CH3OH(g) ,已知反应中有关物质的化学键键能数据如下表所示:
则 CO(g)+2H2(g) CH3OH(g) △H=
CH3OH(g) △H=__________ kJ•mol-1
(2)以甲醇为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池。如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。

B极为电池______ 极,B极的电极反应式为_________________________________ 。
(3)参考合成反应CO(g)+2H2(g) ⇌CH3OH(g)的平衡常数,回答下列问题:
①该反应正反应是___________ (填“放热”或“吸热”)反应;
②在T℃时,1L密闭容器中,投入0.1molCO和0.2molH2,达到平衡时,CO转化率为50%,则T=__________ ℃。
(4)CH3OH也可由CO2和H2合成。在体积为1L的密闭容器中,充入lmolCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH= — 49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图所示。
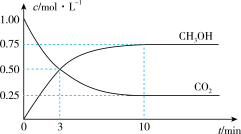
①该反应的平衡常数表达式为K=_______ ;从反应开始到10min,v(H2)=_____ mol/(L·min);
②下列情况能说明该反应一定达到平衡状态的是___________ (填字母)
A.v(CO2)消耗 = v(CH3OH)生成
B.气体的密度不再随时间改变
C.CO2和CH3OH的浓度之比不再随时间改变
D.气体的平均相对分子质量不再随时间改变
③为了加快化学反应速率且使体系中气体的物质的量增大,只改变下列某一条件,可采取的措施有__ (填字母)
A.升高温度 B.缩小容器体积
C.再充入CO2气体 D.使用合适的催化剂
④相同温度下,在另一个容积为1 L的密闭容器中充入2mol CH3OH(g)和2molH2O(g),达到平衡时CO2的浓度_______ (填“>”、“ <”或“=”)0.25mol/L。
(1)工业上利用CO和H2在催化剂作用下合成甲醇:CO(g)+2H2(g) ⇌CH3OH(g) ,已知反应中有关物质的化学键键能数据如下表所示:
| 化学键 | H—H | C—O | C≡O | H—O | C—H |
| E/(kJ/mol) | 436 | 343 | 1076 | 465 | 413 |
则 CO(g)+2H2(g)
(2)以甲醇为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池。如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。

B极为电池
(3)参考合成反应CO(g)+2H2(g) ⇌CH3OH(g)的平衡常数,回答下列问题:
| 温度/℃ | 0 | 50 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 100 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
①该反应正反应是
②在T℃时,1L密闭容器中,投入0.1molCO和0.2molH2,达到平衡时,CO转化率为50%,则T=
(4)CH3OH也可由CO2和H2合成。在体积为1L的密闭容器中,充入lmolCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH= — 49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图所示。

①该反应的平衡常数表达式为K=
②下列情况能说明该反应一定达到平衡状态的是
A.v(CO2)消耗 = v(CH3OH)生成
B.气体的密度不再随时间改变
C.CO2和CH3OH的浓度之比不再随时间改变
D.气体的平均相对分子质量不再随时间改变
③为了加快化学反应速率且使体系中气体的物质的量增大,只改变下列某一条件,可采取的措施有
A.升高温度 B.缩小容器体积
C.再充入CO2气体 D.使用合适的催化剂
④相同温度下,在另一个容积为1 L的密闭容器中充入2mol CH3OH(g)和2molH2O(g),达到平衡时CO2的浓度
工业上合成甲醇一般采用下列反应:CO(g)+2H2(g)⇌CH3OH(g)△H下表是该反应在不同温度下的化学平衡常数(K):
(1)由表中数据判断△H____ 0(填“>”、“=”或“<”)。
(2)某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.5mol·L-1,则此时的温度为_________ ℃。
(3)在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
①反应从2min到4min之间,H2的反应速率为_________ 。
②反应达到平衡时CO的转化率为__________ 。
③反应在第2min时改变了反应条件,改变的条件可能是_________ (填序号)。
a.使用催化剂 b.降低温度 c.增加H2的浓度
(4)常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ·mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ·mol-1
③H2O(g)=H2O(l)△H=-44.0kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:__________
(5)一种甲醇燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧化作用生成水和二氧化碳。该电池的负极反应式为:___________ 。
若以上述燃料电池为电源来电解饱和食盐水,当消耗32g甲醇时,电解产生的H2体积(标况)为__________ L。
| 温度/℃ | 250 | 310 | 350 |
| K/( mol•L-1)-2 | 2.041 | 0.250 | 0.012 |
(1)由表中数据判断△H
(2)某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.5mol·L-1,则此时的温度为
(3)在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
浓度/ mol•L-1 时间/min | c(CO) | c(H2) | c(CH3OH) |
| 0 | 0.8 | 1.6 | 0 |
| 2 | 0.6 | x | 0.2 |
| 4 | 0.3 | 0.6 | 0.5 |
| 6 | 0.3 | 0.6 | 0.5 |
①反应从2min到4min之间,H2的反应速率为
②反应达到平衡时CO的转化率为
③反应在第2min时改变了反应条件,改变的条件可能是
a.使用催化剂 b.降低温度 c.增加H2的浓度
(4)常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ·mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ·mol-1
③H2O(g)=H2O(l)△H=-44.0kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(5)一种甲醇燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧化作用生成水和二氧化碳。该电池的负极反应式为:
若以上述燃料电池为电源来电解饱和食盐水,当消耗32g甲醇时,电解产生的H2体积(标况)为
能源、环境与生产生活和社会发展密切相关。
(1)工业上利用CO和H2在催化剂作用下合成甲醇:CO(g)+2H2(g) CH3OH(g),已知反应中有关物质的化学键键能数据如表所示:
CH3OH(g),已知反应中有关物质的化学键键能数据如表所示:
则CO(g)+2H2(g) CH3OH(g)△H=
CH3OH(g)△H=__ kJ•mol-1
(2)以甲醇为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池。如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。

B极为电池__ 极,B极的电极反应式为___ 。
(3)参考合成反应CO(g)+2H2(g) CH3OH(g)的平衡常数,回答下列问题:
CH3OH(g)的平衡常数,回答下列问题:
①该反应正反应是__ (填“放热”或“吸热”)反应;
②在T℃时,1L密闭容器中,投入0.1molCO和0.2molH2,达到平衡时,CO转化率为50%,则T=__ ℃。
(4)CH3OH也可由CO2和H2合成。在体积为1L的密闭容器中,充入lmolCO2和3molH2,一定条件下反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH=-49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图所示。
CH3OH(g)+H2O(g)ΔH=-49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图所示。

①该反应的平衡常数表达式为K=__ ;从反应开始到10min,v(H2)=__ mol/(L·min);
②下列情况能说明该反应一定达到平衡状态的是__ (填字母)。
A.v(CO2)消耗=v(CH3OH)生成
B.气体的密度不再随时间改变
C.CO2和CH3OH的浓度之比不再随时间改变
D.气体的平均相对分子质量不再随时间改变
(1)工业上利用CO和H2在催化剂作用下合成甲醇:CO(g)+2H2(g)
 CH3OH(g),已知反应中有关物质的化学键键能数据如表所示:
CH3OH(g),已知反应中有关物质的化学键键能数据如表所示:| 化学键 | H—H | C—O | C≡O | H—O | C—H |
| E/(kJ/mol) | 436 | 343 | 1076 | 465 | 413 |
 CH3OH(g)△H=
CH3OH(g)△H=(2)以甲醇为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池。如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。

B极为电池
(3)参考合成反应CO(g)+2H2(g)
 CH3OH(g)的平衡常数,回答下列问题:
CH3OH(g)的平衡常数,回答下列问题:| 温度/℃ | 0 | 50 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 100 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
②在T℃时,1L密闭容器中,投入0.1molCO和0.2molH2,达到平衡时,CO转化率为50%,则T=
(4)CH3OH也可由CO2和H2合成。在体积为1L的密闭容器中,充入lmolCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)ΔH=-49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图所示。
CH3OH(g)+H2O(g)ΔH=-49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图所示。
①该反应的平衡常数表达式为K=
②下列情况能说明该反应一定达到平衡状态的是
A.v(CO2)消耗=v(CH3OH)生成
B.气体的密度不再随时间改变
C.CO2和CH3OH的浓度之比不再随时间改变
D.气体的平均相对分子质量不再随时间改变
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


