解答题-原理综合题 较难0.4 引用1 组卷14
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g) ΔH = a kJ·mol-1
2Fe(s)+3CO2(g) ΔH = a kJ·mol-1
(1)已知:①Fe2O3(s) + 3C(石墨) = 2Fe(s) + 3CO(g) ΔH1= + 489.0 kJ·mol-1
②C(石墨) + CO2(g) = 2CO(g) ΔH2 = +172.5 kJ·mol-1
则a =_____________ kJ·mol-1。
(2)冶炼铁反应的平衡常数表达式K =__________ ,温度升高后,K值_________ (填“增大”、“不变”或“减小”)。
(3)在T℃时,该反应的平衡常数K=64,在 2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
①甲容器中CO的平衡转化率为________________________ 。
②下列说法正确的是__________________ (填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.增加Fe2O3可以提高CO的转化率
c.甲、乙容器中,CO的平衡浓度之比为2∶3
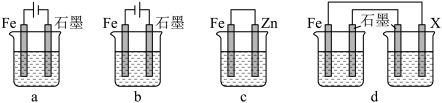
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在abc装置中能保护铁的是___________________ (填字母)
②若用d装置保护铁,X极的电极材料应是____________________ (填名称)
 2Fe(s)+3CO2(g) ΔH = a kJ·mol-1
2Fe(s)+3CO2(g) ΔH = a kJ·mol-1(1)已知:①Fe2O3(s) + 3C(石墨) = 2Fe(s) + 3CO(g) ΔH1= + 489.0 kJ·mol-1
②C(石墨) + CO2(g) = 2CO(g) ΔH2 = +172.5 kJ·mol-1
则a =
(2)冶炼铁反应的平衡常数表达式K =
(3)在T℃时,该反应的平衡常数K=64,在 2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
①甲容器中CO的平衡转化率为
②下列说法正确的是
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.增加Fe2O3可以提高CO的转化率
c.甲、乙容器中,CO的平衡浓度之比为2∶3
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在abc装置中能保护铁的是
②若用d装置保护铁,X极的电极材料应是

19-20高三上·黑龙江牡丹江·阶段练习
类题推荐
根据要求回答下列有关问题。
(1)高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ∆H=-28.5kJ/mol,冶炼铁反应的平衡常数表达式K=
2Fe(s)+3CO2(g) ∆H=-28.5kJ/mol,冶炼铁反应的平衡常数表达式K=____________ ,温度升高后,K 值________ (填“增大”、“不变”或“减小”)。
(2)已知:①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ∆H1= +489.0kJ/mol
②Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ∆H2= -28.5kJ/mol
2Fe(s)+3CO2(g) ∆H2= -28.5kJ/mol
③C(石墨)+ CO2(g) = 2CO(g) ∆H3= akJ/mol ,
则a=__________ kJ/mol。
(3)在T℃时,反应Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器中,按下表所示加入物质,经过一段时间后达到平衡。
2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器中,按下表所示加入物质,经过一段时间后达到平衡。
①平衡时CO 的转化率为_______ 。
②下列情况标志反应达到平衡状态的是________ (填字母)。
a.容器内气体密度保持不变
b.容器内气体压强保持不变
c.CO的消耗速率和CO2的生成速率相等
(1)高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)
 2Fe(s)+3CO2(g) ∆H=-28.5kJ/mol,冶炼铁反应的平衡常数表达式K=
2Fe(s)+3CO2(g) ∆H=-28.5kJ/mol,冶炼铁反应的平衡常数表达式K=(2)已知:①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ∆H1= +489.0kJ/mol
②Fe2O3(s)+3CO(g)
 2Fe(s)+3CO2(g) ∆H2= -28.5kJ/mol
2Fe(s)+3CO2(g) ∆H2= -28.5kJ/mol③C(石墨)+ CO2(g) = 2CO(g) ∆H3= akJ/mol ,
则a=
(3)在T℃时,反应Fe2O3(s)+3CO(g)
 2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器中,按下表所示加入物质,经过一段时间后达到平衡。
2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器中,按下表所示加入物质,经过一段时间后达到平衡。| Fe2O3 | CO | Fe | CO2 | |
| 始态mol | 1.0 | 1.0 | 1.0 | 1.0 |
②下列情况标志反应达到平衡状态的是
a.容器内气体密度保持不变
b.容器内气体压强保持不变
c.CO的消耗速率和CO2的生成速率相等
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ΔH
2Fe(s)+3CO2(g) ΔH
(1)已知:① Fe2O3(s)+ 3C(石墨)=2Fe(s)+3CO(g) ΔH1 ②C(石墨)+CO2(g)=2CO(g) ΔH2,则ΔH=______ (用含ΔH1、ΔH2代数式表示)
(2)高炉炼铁反应的平衡常数表达式K=_____________ 。
(3)在T℃时,该反应的平衡常数K=64,在 2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
①甲容器中CO的平衡转化率为______ 。
②下列说法正确的是______ 。
A. 若容器压强恒定,反应达到平衡状态 B. 若容器内气体密度恒定,反应达平衡
C. 甲容器中CO的平衡转化率大于乙的 D. 增加Fe2O3就能提高CO的转化率
 2Fe(s)+3CO2(g) ΔH
2Fe(s)+3CO2(g) ΔH (1)已知:① Fe2O3(s)+ 3C(石墨)=2Fe(s)+3CO(g) ΔH1 ②C(石墨)+CO2(g)=2CO(g) ΔH2,则ΔH=
(2)高炉炼铁反应的平衡常数表达式K=
(3)在T℃时,该反应的平衡常数K=64,在 2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
①甲容器中CO的平衡转化率为
②下列说法正确的是
A. 若容器压强恒定,反应达到平衡状态 B. 若容器内气体密度恒定,反应达平衡
C. 甲容器中CO的平衡转化率大于乙的 D. 增加Fe2O3就能提高CO的转化率
根据要求回答下列有关问题。
(1)甲醇是一种重要的化工原料,工业上利用CO2和H2在一定条件下反应合成甲醇。已知:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1=-1275.6kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566.0kJ·mol-1
③H2O(g)=H2O(l) ΔH3=-44.0kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:___ 。
(2)高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ∆H=-28.5kJ/mol,冶炼铁反应的平衡常数表达式K=
2Fe(s)+3CO2(g) ∆H=-28.5kJ/mol,冶炼铁反应的平衡常数表达式K=__ ,温度升高后,K值__ (填“增大”、“不变”或“减小”)。
(3)在T℃时,反应Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器中,按下表所示加入物质,经过一段时间后达到平衡。
2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器中,按下表所示加入物质,经过一段时间后达到平衡。
①平衡时CO 的转化率为___ 。
②下列情况标志反应达到平衡状态的是__ (填字母)。
a.容器内气体密度保持不变
b.容器内气体压强保持不变
c.CO的消耗速率和CO2的生成速率相等
d.容器内气体的平均相对分子质量保持不变
(1)甲醇是一种重要的化工原料,工业上利用CO2和H2在一定条件下反应合成甲醇。已知:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1=-1275.6kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566.0kJ·mol-1
③H2O(g)=H2O(l) ΔH3=-44.0kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(2)高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)
 2Fe(s)+3CO2(g) ∆H=-28.5kJ/mol,冶炼铁反应的平衡常数表达式K=
2Fe(s)+3CO2(g) ∆H=-28.5kJ/mol,冶炼铁反应的平衡常数表达式K=(3)在T℃时,反应Fe2O3(s)+3CO(g)
 2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器中,按下表所示加入物质,经过一段时间后达到平衡。
2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器中,按下表所示加入物质,经过一段时间后达到平衡。| Fe2O3 | CO | Fe | CO2 | |
| 始态mol | 1.0 | 1.0 | 1.0 | 1.0 |
①平衡时CO 的转化率为
②下列情况标志反应达到平衡状态的是
a.容器内气体密度保持不变
b.容器内气体压强保持不变
c.CO的消耗速率和CO2的生成速率相等
d.容器内气体的平均相对分子质量保持不变
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


