解答题-工业流程题 适中0.65 引用2 组卷222
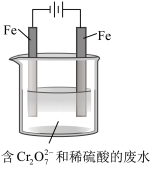
I.含铬(+6价)废水严重危害人体健康,工业上常用还原法进行处理。其部分工艺流程如下:
(1)废水中,六价铬以 或者
或者 的形式存在,写出其相互转化的离子方程式
的形式存在,写出其相互转化的离子方程式______ 。我国常用 做还原剂,写出“还原池”中反应的离子方程式
做还原剂,写出“还原池”中反应的离子方程式____ (六价铬还原态为三价铬离子)。
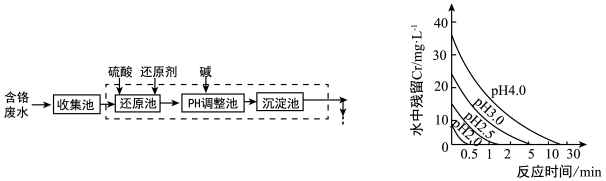
(2)废水中残留六价铬的浓度随溶液pH变化如图所示。实际生产中 需控制 ,原因可能
,原因可能
是________ 。
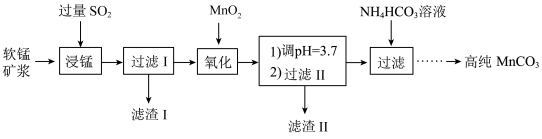
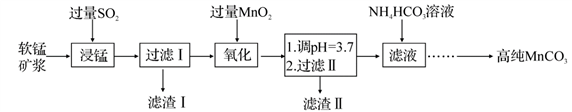
II.工业以软锰矿(主要成分是 ,含有
,含有 、
、 等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:

已知: 时,铁元素主要以氢氧化物形态存在。
时,铁元素主要以氢氧化物形态存在。
“浸锰”过程中 与
与 反应的离子方程式为
反应的离子方程式为 ,该反应是经历以下两步反应实现的。
,该反应是经历以下两步反应实现的。
i.
ii.……
(3)“过滤I”所得滤液中主要存在的两种金属阳离子为___________ (填离子符号);
(4)“氧化”过程中被 氧化的物质有
氧化的物质有___________ (写化学式);
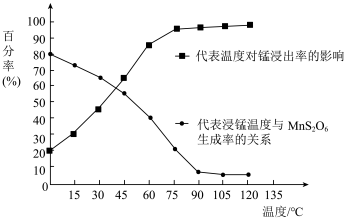
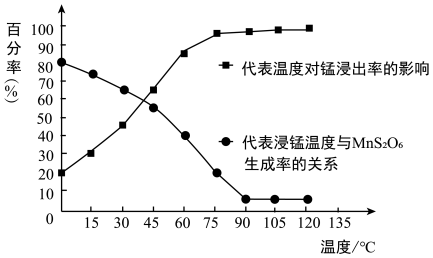
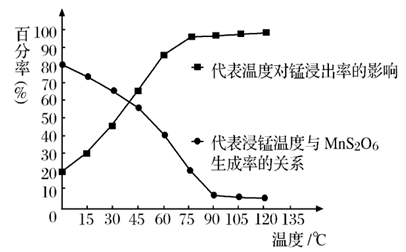
(5)“浸锰”反应中往往有副产物 生成,温度对“浸锰”反应的影响如图所示:为减少
生成,温度对“浸锰”反应的影响如图所示:为减少 的生成,“浸锰”的适宜温度是
的生成,“浸锰”的适宜温度是___________ ;
(6)加入 溶液后,生成
溶液后,生成 沉淀,同时还有气体生成,写出反应的离子方程式:
沉淀,同时还有气体生成,写出反应的离子方程式:_______ ,向过滤II所得的滤液中加入 溶液时温度不宜太高的原因是
溶液时温度不宜太高的原因是_____ 。

(1)废水中,六价铬以
(2)废水中残留六价铬的浓度随溶液pH变化如图所示。
是
II.工业以软锰矿(主要成分是

已知:
“浸锰”过程中
i.
ii.……
(3)“过滤I”所得滤液中主要存在的两种金属阳离子为
(4)“氧化”过程中被
(5)“浸锰”反应中往往有副产物

(6)加入
21-22高二上·四川成都·阶段练习
类题推荐
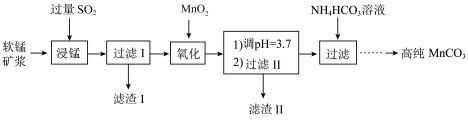
工业以软锰矿(主要成分是 MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
已知:25℃时,部分金属阳离子以氢氧化物形式沉淀时溶液的pH 如下表所示。
(1)“浸锰”过程中 Fe2O3与SO2反应的离子方程式为 Fe2O3+SO2+2H+ =2Fe2++SO42-+H2O,该反应是经历以下两步反应实现的。
写出ⅱ的离子方程式:_______________________ 。
ⅰ:Fe2O3+6H+ =2Fe3++3H2O ⅱ:……
(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为_________ (填离子符号)。
(3)写出“氧化”过程中MnO2 与Fe 2+反应的离子方程式:___________ 。
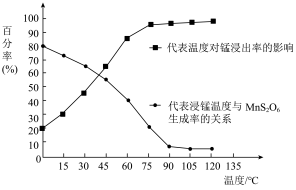
(4)“浸锰”反应中往往有副产物 MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是;_____ 滤渣Ⅱ的成分是______ (写化学式);向过滤Ⅱ所得的滤液中加入NH4HCO3 溶液时温度不宜太高的原因是______________ 。
(5)加入NH4HCO3溶液后,生成 MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:__________________ 。
(6)生成的 MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是_______________ 。

已知:25℃时,部分金属阳离子以氢氧化物形式沉淀时溶液的pH 如下表所示。
| 金属阳离子 | Fe3+ | Fe2+ | Mn2+ |
| 开始沉淀的pH | 2.7 | 7.6 | 8.3 |
| 完全沉淀的pH | 3.7 | 9.7 | 9.8 |
(1)“浸锰”过程中 Fe2O3与SO2反应的离子方程式为 Fe2O3+SO2+2H+ =2Fe2++SO42-+H2O,该反应是经历以下两步反应实现的。
写出ⅱ的离子方程式:
ⅰ:Fe2O3+6H+ =2Fe3++3H2O ⅱ:……
(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为
(3)写出“氧化”过程中MnO2 与Fe 2+反应的离子方程式:
(4)“浸锰”反应中往往有副产物 MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是;

(5)加入NH4HCO3溶液后,生成 MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:
(6)生成的 MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网