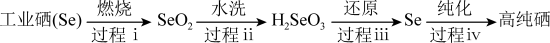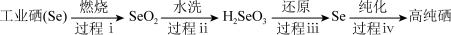填空题 适中0.65 引用1 组卷99
硫和硒(34Se)在元素周期表中位于同一主族,均是生产生活中重要的非金属元素。
(1)含+4价硫元素的化合物有SO2、H2SO3和X等。
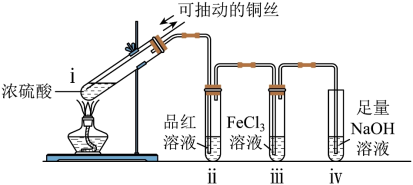
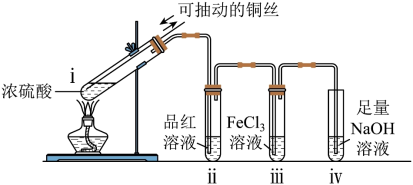
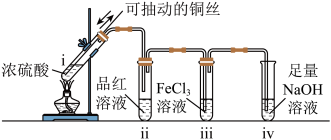
①SO2能使品红溶液褪色,说明SO2具有的化学性质是___________ 。
②已知X属于钠盐。写出X与稀硫酸反应生成SO2的化学方程式:___________ 。
(2)以工业硒为原料制备高纯硒时的主要物质转化关系如图所示。
工业硒(Se) SeO2
SeO2 H2SeO3
H2SeO3 Se
Se 高纯硒
高纯硒
①下列说法正确的是___________ (填字母序号)。
A.硒原子的最外层有6个电子
B.硒元素的非金属性强于硫元素的非金属性
C.SeO2属于酸性氧化物
D.过程ⅰ中硒被氧化
②过程ⅲ中使用的还原剂为N2H4·nH2O,对应产物是N2.理论上,过程ⅰ消耗的O2与过程ⅲ消耗的N2H4·nH2O的物质的量之比为___________ (工业硒中杂质与O2的反应可忽略)。
(1)含+4价硫元素的化合物有SO2、H2SO3和X等。
①SO2能使品红溶液褪色,说明SO2具有的化学性质是
②已知X属于钠盐。写出X与稀硫酸反应生成SO2的化学方程式:
(2)以工业硒为原料制备高纯硒时的主要物质转化关系如图所示。
工业硒(Se)
①下列说法正确的是
A.硒原子的最外层有6个电子
B.硒元素的非金属性强于硫元素的非金属性
C.SeO2属于酸性氧化物
D.过程ⅰ中硒被氧化
②过程ⅲ中使用的还原剂为N2H4·nH2O,对应产物是N2.理论上,过程ⅰ消耗的O2与过程ⅲ消耗的N2H4·nH2O的物质的量之比为
21-22高二上·江苏宿迁·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网