解答题-原理综合题 适中0.65 引用2 组卷123
利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g)△H1
CH3OH(g)△H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g) CO(g)+H2O(g)△H3
CO(g)+H2O(g)△H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
由此计算△H1=___ kJ·mol-1,已知△H2=-58kJ·mol-1,则△H3=___ kJ·mol-1。
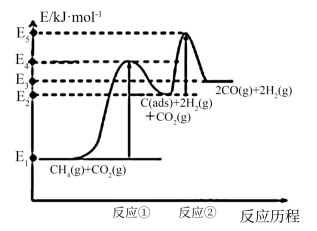
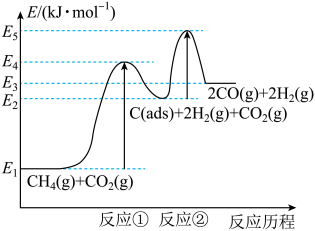
(2)科学家提出制备“合成气反应历程分两步:
反应①:CH4(g)=C(ads)+2H2(g)(慢反应)
反应②:C(ads)+CO2(g)=2CO(g)(快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图所示:
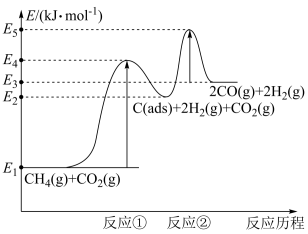
CH4与CO2制备合成气的热化学方程式为__ 。
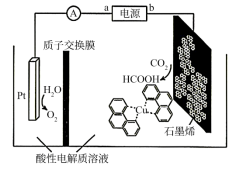
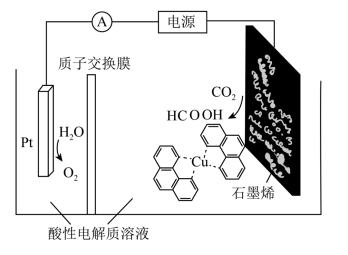
(3)利用铜基配合物1,10—phenanthroline—Cu催化剂电催化CO2还原制备碳基燃料(包括CO、烷烃和酸等)是减少CO2在大气中累积和实现可再生能源有效利用的关键手段之,其装置原理如图所示。
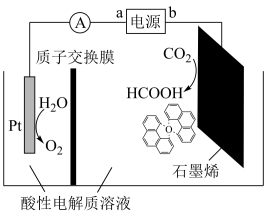
①电池工作过程中,图中Pt电极附近溶液的pH__ (填“变大”或“变小”),阴极的电极反应式为___ 。
②每转移2mol电子,阴极室溶液质量增加___ g。
(4)利用“Na—CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na—CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2 2Na2CO3+C.放电时该电池“吸入CO2,其工作原理如图所示:
2Na2CO3+C.放电时该电池“吸入CO2,其工作原理如图所示:
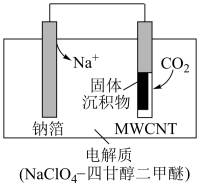
①放电时,正极的电极反应式为___ 。
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2mol电子时,两极的质量差为___ g。(假设放电前两电极质量相等)
①CO(g)+2H2(g)
②CO2(g)+3H2(g)
③CO2(g)+H2(g)
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 | H—H | C—O | C≡O | H—O | C—H |
| E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
(2)科学家提出制备“合成气反应历程分两步:
反应①:CH4(g)=C(ads)+2H2(g)(慢反应)
反应②:C(ads)+CO2(g)=2CO(g)(快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图所示:

CH4与CO2制备合成气的热化学方程式为
(3)利用铜基配合物1,10—phenanthroline—Cu催化剂电催化CO2还原制备碳基燃料(包括CO、烷烃和酸等)是减少CO2在大气中累积和实现可再生能源有效利用的关键手段之,其装置原理如图所示。

①电池工作过程中,图中Pt电极附近溶液的pH
②每转移2mol电子,阴极室溶液质量增加
(4)利用“Na—CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na—CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2

①放电时,正极的电极反应式为
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2mol电子时,两极的质量差为
21-22高三上·黑龙江鹤岗·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网