解答题-原理综合题 适中0.65 引用1 组卷80
工业生产硫酸中,SO2的催化氧化是关键步骤,排放处理未达标的尾气会产生严重的空气污染。回答下列问题:
(1)SO2是形成酸雨的污染物之一,酸雨的pH范围是___________ 。
(2)已知:①

②

③

写出Cu2S和O2反应生成 和SO2的热化学方程式
和SO2的热化学方程式___________ 。
(3)硫酸工业中涉及反应:
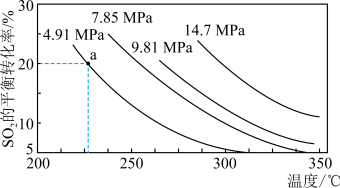
 。一定条件下,在恒压密闭容器中,通入2 molSO2和1 mol O2发生上述反应,
。一定条件下,在恒压密闭容器中,通入2 molSO2和1 mol O2发生上述反应, 的平衡转化率和压强、温度的关系如图所示。a点时该反应的压强平衡常数Kp=
的平衡转化率和压强、温度的关系如图所示。a点时该反应的压强平衡常数Kp=___________ (保留三位有效数字,已知:分压=气体总压强×该气体的物质的量分数,用各气体物质的分压替代浓度计算的平衡常数叫压强平衡常数)。恒压条件下,关于该反应的下列说法中正确的是___________ 。
A.Q大于0
B.相同时间内生成0.2 mol SO2,同时消耗0.1 mol O2,反应达到平衡
C.相同温度下压强越大,SO2的转化率就越大,该反应的平衡常数就越大
D.反应达到平衡后,保持温度不变,再充入2 mol SO2和1 mol O2,SO2的平衡转化率不变
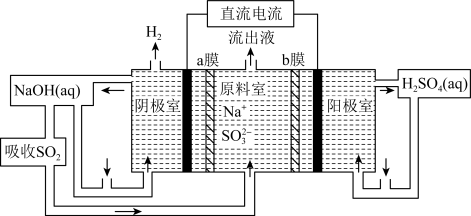
(4)用如图装置回收SO2,可制得硫酸,电极均为惰性电极,a、b膜分别为阳离子、阴离子交换膜,写出阴极的电极反应式___________ 。当阴极收集到标准状况下的H2 44.8 L时,理论上在阳极能得到___________ gH2SO4。
(1)SO2是形成酸雨的污染物之一,酸雨的pH范围是
(2)已知:①
②
③
写出Cu2S和O2反应生成
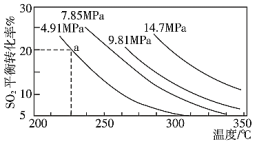
(3)硫酸工业中涉及反应:

A.Q大于0
B.相同时间内生成0.2 mol SO2,同时消耗0.1 mol O2,反应达到平衡
C.相同温度下压强越大,SO2的转化率就越大,该反应的平衡常数就越大
D.反应达到平衡后,保持温度不变,再充入2 mol SO2和1 mol O2,SO2的平衡转化率不变
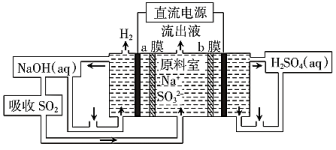
(4)用如图装置回收SO2,可制得硫酸,电极均为惰性电极,a、b膜分别为阳离子、阴离子交换膜,写出阴极的电极反应式

21-22高二上·湖北黄石·阶段练习
类题推荐
丙烯是重要的化工原料,可用于生产丙醇、卤代烃和塑料。
(1)工业上用丙烯加成法制备1,2—二氯丙烷,主要副产物为3—氯丙烯, 反应原理为:
Ⅰ.CH2=CHCH3(g)+Cl2(g) CH2ClCHClCH3(g) △H1=—134 kJ/mol
CH2ClCHClCH3(g) △H1=—134 kJ/mol
Ⅱ.CH2=CHCH3(g)+Cl2(g) CH2=CHCH2Cl(g)+HCl(g) △H2=—102 kJ/mol
CH2=CHCH2Cl(g)+HCl(g) △H2=—102 kJ/mol
则CH2=CHCH2Cl(g)+HCl(g) CH2ClCHClCH3(g) △H3=
CH2ClCHClCH3(g) △H3=_______ kJ/mol
(2)某研究小组向密闭容器中充入一定量的CH2=CHCH3,分别在A、B两种不同便化利作用下发生反应,一段时间后测得CH2ClCHClCH3的产率与温度的关系如下图所示。

下列说法错误的是_______(填代号)。
(3)C3H8(g)  C3H6(g)+H2(g)在不同温度下达到平衡,在总压强分别为p1和p2时,测得丙烷及丙烯的物质的量分数如图所示。
C3H6(g)+H2(g)在不同温度下达到平衡,在总压强分别为p1和p2时,测得丙烷及丙烯的物质的量分数如图所示。

①p1_______ p2(填“大于”、“小于”或“等于”)。
②起始时充入一定量丙烷,在恒压p1=0.2MPa条件下发生反应,Q点对应温度下丙烷的转化率为_______ (保留1位小数),该反应的平衡常数Kp=_______ MPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)下图是一个电化学过程的示意图:

①写出甲池中通入CH3OH一极的电极反应式:_______ 。
②丙池是体积为100 mL 含有如下离子的溶液:
电解一段时间后,当两极收集到相同条件下相同体积的气体时,阳板上收集到氧气的物质的量为_______ 。(忽略溶液体积的变化和气体产物的溶解)
(1)工业上用丙烯加成法制备1,2—二氯丙烷,主要副产物为3—氯丙烯, 反应原理为:
Ⅰ.CH2=CHCH3(g)+Cl2(g)
Ⅱ.CH2=CHCH3(g)+Cl2(g)
则CH2=CHCH2Cl(g)+HCl(g)
(2)某研究小组向密闭容器中充入一定量的CH2=CHCH3,分别在A、B两种不同便化利作用下发生反应,一段时间后测得CH2ClCHClCH3的产率与温度的关系如下图所示。

下列说法错误的是_______(填代号)。
| A.使用催化剂A的最佳温度约为250℃ |
| B.相同条件下,改变压强不影响CH2ClCHClCH3的产率 |
| C.两种催化剂均能降低反应的活化能,但△H不变 |
| D.P点可能为对应温度下CH2ClCHClCH3的平衡产率 |

①p1
②起始时充入一定量丙烷,在恒压p1=0.2MPa条件下发生反应,Q点对应温度下丙烷的转化率为
(4)下图是一个电化学过程的示意图:

①写出甲池中通入CH3OH一极的电极反应式:
②丙池是体积为100 mL 含有如下离子的溶液:
| 离子 | Cu2+ | H+ | Cl— | |
| 浓度(mol/L) | 1.0 | 4.0 | 4.0 | 1.0 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网