解答题-原理综合题 适中0.65 引用1 组卷51
由H、C、N、O、S等元素形成多种化合物在生产生活中有着重要应用。
(1)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。
已知:①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-159.5 kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+116.5 kJ/mol
③H2O(l)=H2O(g) ΔH=+44.0 kJ/mol
写出CO2与NH3合成尿素同时生成液态水的热化学反应方程式:___________ 。
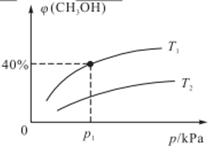
(2)某密闭容器中存在反应:CO(g)+2H2(g) CH3OH(g),起始时容器中只有a mol/LCO和b mol/L H2,平衡时测得混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图所示。
CH3OH(g),起始时容器中只有a mol/LCO和b mol/L H2,平衡时测得混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图所示。
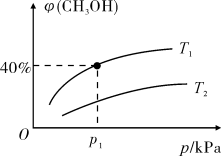
①温度T1和T2时对应的平衡常数分别为K1、K2,则K1___________ K2(填“>”“<”或“=”);
②若恒温恒容条件下,起始时充入1 mol CO和2 mol H2,达平衡后,CO的转化率为α1,此时,若再充入1 mol CO和2 mol H2,再次达平衡后,CO的转化率为α2,则α1___________ α2(填“>”“<”“=”或“无法确定”)。
(3)最近有人尝试用H2还原工业尾气中SO2,该反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:
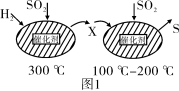
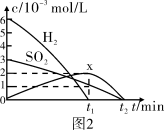
①分析可知X为___________ (写化学式),0~t1时间段的温度为___________ ,0~t1时间段用SO2表示的化学反应速率为___________ 。
②总反应的化学方程式为___________ 。
(1)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。
已知:①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-159.5 kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+116.5 kJ/mol
③H2O(l)=H2O(g) ΔH=+44.0 kJ/mol
写出CO2与NH3合成尿素同时生成液态水的热化学反应方程式:
(2)某密闭容器中存在反应:CO(g)+2H2(g)

①温度T1和T2时对应的平衡常数分别为K1、K2,则K1
②若恒温恒容条件下,起始时充入1 mol CO和2 mol H2,达平衡后,CO的转化率为α1,此时,若再充入1 mol CO和2 mol H2,再次达平衡后,CO的转化率为α2,则α1
(3)最近有人尝试用H2还原工业尾气中SO2,该反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:


①分析可知X为
②总反应的化学方程式为
21-22高二上·湖北黄石·阶段练习
类题推荐
碳、氮、硫的化合物在生产生活中广泛存在。请回答:
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-l59.5 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) ΔH=-160.5 kJ·mol-1
③H2O(l)=H2O(g) ΔH=+44.0 kJ·mol-1
写出CO2与NH3合成尿素和气态水的热化学反应方程式____________ 。
(2)T1温度时在容积为2L的恒容密闭容器中只充入1.00molNO2气体发生反应:2NO(g)+O2(g)⇌2NO2(g) ∆H<0。实验测得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),
k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO2)如下表:
①从0~2s该反应的平均速率v(NO2)=___________ 。
②T1温度时化学平衡常数K=___________ mol-1·L。
③化学平衡常数K与速率常数k正、k逆的数学关系是K=___________ 。若将容器的温度改变为T2时其k正=k逆,则T1__________ T2 (填“>”、“<”或“=”)。
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是____________________ (写出主要反应的离子方程式),该溶液中,c(Na+)______ 2c( )+c(
)+c( )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。
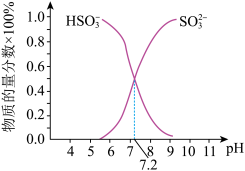
②在某NaHSO3、Na2SO3混合溶液中 、
、 物质的量分数随pH变化曲线如图所示(部分),根据图示,则
物质的量分数随pH变化曲线如图所示(部分),根据图示,则 的第一步水解平衡常数=
的第一步水解平衡常数=________ 。
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-l59.5 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) ΔH=-160.5 kJ·mol-1
③H2O(l)=H2O(g) ΔH=+44.0 kJ·mol-1
写出CO2与NH3合成尿素和气态水的热化学反应方程式
(2)T1温度时在容积为2L的恒容密闭容器中只充入1.00molNO2气体发生反应:2NO(g)+O2(g)⇌2NO2(g) ∆H<0。实验测得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),
k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO2)如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO2)/mol | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
①从0~2s该反应的平均速率v(NO2)=
②T1温度时化学平衡常数K=
③化学平衡常数K与速率常数k正、k逆的数学关系是K=
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是
②在某NaHSO3、Na2SO3混合溶液中

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 CH3OH(g)
CH3OH(g)