解答题-实验探究题 适中0.65 引用1 组卷220
在探究“不同价态含硫物质的转化”实验中,某实验小组选定“-2→0硫元素的转化”进行探究。
(1)小方拟用H2O2与H2S反应,则氧化剂与还原剂的物质的量之比为___________ 。
(2)小明结合已有知识,计划选用Cl2与H2S反应。在讨论设计实验方案时,小组同学提出两种方案:
方案I:用干燥Cl2与H2S反应
方案II:用潮湿的Cl2与H2S反应
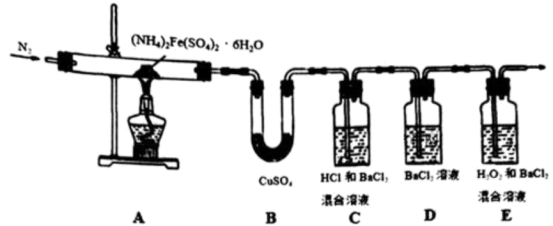
小组同学设计了以下实验装置并动手实验、验证方案:
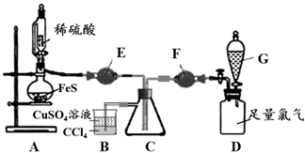
①证明以上装置气密性良好的具体操作是___________ 。
②仪器E的名称是___________ 。
③装置B的作用是___________ 。(答2点)
④E中的试剂是___________ 。先通H2S排出装置中的空气,证明H2S已充满的现象是___________ (用离子方程式表示)。
⑤G中的试剂是___________ 。通过什么现象判断氯气已过量?___________ 。
⑥分析与讨论:实验II中黄色沉淀消失是S元素转变成了___________ (填离子符号),证明推测合理的实验操作和现象是:___________ 。
实验结论:-2→0硫元素的转化,氧化剂的选择、用量和反应环境均会影响结果。
(1)小方拟用H2O2与H2S反应,则氧化剂与还原剂的物质的量之比为
(2)小明结合已有知识,计划选用Cl2与H2S反应。在讨论设计实验方案时,小组同学提出两种方案:
方案I:用干燥Cl2与H2S反应
方案II:用潮湿的Cl2与H2S反应
小组同学设计了以下实验装置并动手实验、验证方案:

①证明以上装置气密性良好的具体操作是
②仪器E的名称是
③装置B的作用是
| 实验序号 | 实验操作 | 实验现象 | 结论 |
| I | 滴加稀硫酸,使H2S充满C瓶④,再打开G中的旋塞,缓慢通入Cl2至过量⑤。 | C中有淡黄色固体产生,Cl2通入过量,淡黄色固体不消失。 | 淡黄色固体为单质硫,不会与过量的氯气反应。 |
| II | 撤去E、F装置,在C中加入少量水,先向C瓶通入H2S,再通入Cl2至过量。 | C中看到淡黄色浑浊,通入Cl2过量,淡黄色沉淀消失⑥。 | 有水存在时,淡黄色固体会与过量氯气进一步反应。 |
⑤G中的试剂是
⑥分析与讨论:实验II中黄色沉淀消失是S元素转变成了
实验结论:-2→0硫元素的转化,氧化剂的选择、用量和反应环境均会影响结果。
21-22高三上·广东·阶段练习
类题推荐
工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),流程图如下:
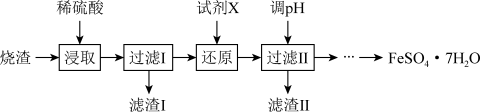
已知:SiO2不溶于稀硫酸,请回答下列问题:
(1)硫铁矿中S元素的价态为___________ ,滤渣I的成分为___________ 。
(2)还原步骤中,加入的试剂X为SO2,则该反应的离子方程式为___________ ,滤渣II的主要成分是___________ (填化学式)。
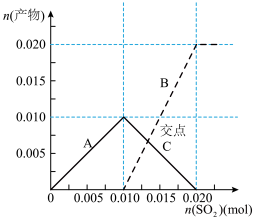
(3)实验室中可用NaOH溶液回收过量的SO2气体,将SO2气体通入到0.100mol/L200mLNaOH溶液中,溶液中含硫元素的离子的物质的量与SO2的通入量的关系如图:虚线B是___________ 的变化曲线(填离子符号)交点C处发生反应的离子方程式为___________ 。
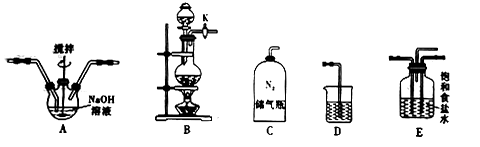
II.硫酸亚铁(FeSO4)加热至高温会分解,某活动小组设计实验验证其分解产物,装置如图所示,组装好仪器(已省略夹持仪器),在一定温度下按上述图示装置进行实验。
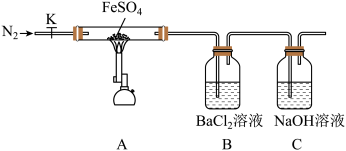
(4)组装好实验装置后,要进行的下一步操作是___________ ;实验开始时通入氮气的目的是___________ 。
(5)B中实验现象证明分解产物中含有___________ (写化学式)。依据实验2硬质玻璃管中加热冷却后的固体性质确定分解产物有___________ (写化学式)。
(6)某同学欲通过下列实验验证分解产物中含有的另一种非金属氧化物。
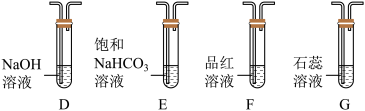
①从实验装置D、E、F、G中,选用两个装置与装置A连接进行实验,依次连接的合理顺序为A→___________ ;
②能证明生成了另一种非金属氧化物的现象是___________ 。该现象体现了该物质的___________ 性。写出该条件下硫酸亚铁受热分解的化学方程式___________ 。

已知:SiO2不溶于稀硫酸,请回答下列问题:
(1)硫铁矿中S元素的价态为
(2)还原步骤中,加入的试剂X为SO2,则该反应的离子方程式为
(3)实验室中可用NaOH溶液回收过量的SO2气体,将SO2气体通入到0.100mol/L200mLNaOH溶液中,溶液中含硫元素的离子的物质的量与SO2的通入量的关系如图:虚线B是

II.硫酸亚铁(FeSO4)加热至高温会分解,某活动小组设计实验验证其分解产物,装置如图所示,组装好仪器(已省略夹持仪器),在一定温度下按上述图示装置进行实验。

| 序号 | 操作步骤 | 实验现象 |
| 1 | 打开K,通入一段时间的N2,关闭活塞K,加热A中的玻璃管一段时间 | B中产生大量白色沉淀 |
| 2 | A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却 | 硬质玻璃管中最终可以看到红棕色固体物质 |
(4)组装好实验装置后,要进行的下一步操作是
(5)B中实验现象证明分解产物中含有
(6)某同学欲通过下列实验验证分解产物中含有的另一种非金属氧化物。

①从实验装置D、E、F、G中,选用两个装置与装置A连接进行实验,依次连接的合理顺序为A→
②能证明生成了另一种非金属氧化物的现象是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网