解答题-工业流程题 较难0.4 引用1 组卷479
高铁酸钾( )是一种新型、高效、优质的水处理剂,有多种制取方法。
)是一种新型、高效、优质的水处理剂,有多种制取方法。
已知: 为紫色固体,易溶于水,微溶于浓
为紫色固体,易溶于水,微溶于浓 溶液;具有强氧化性,在酸性或中性溶液中快速产生
溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在
,在 、强碱性溶液中较稳定。
、强碱性溶液中较稳定。
(1)氯气氧化氢氧化铁制备 (夹持装置略)
(夹持装置略)_______ 。
②装置C中得到紫色固体,主要反应的化学方程式为_______ 。
(2)强碱性介质中, 氧化
氧化 制备高铁酸钾。纯
制备高铁酸钾。纯 粗产品[含有
粗产品[含有 、
、 等杂质]的实验方案为:在不断搅拌下,将一定量的
等杂质]的实验方案为:在不断搅拌下,将一定量的 粗产品溶于冷的
粗产品溶于冷的 溶液中,快速过滤,
溶液中,快速过滤,_______ 。(实验中须使用的试剂有:冰水混合物,饱和 溶液,乙醇)。
溶液,乙醇)。
(3)测定高铁酸钾样品的纯度
①称取 高铁酸钾样品,完全溶解于浓
高铁酸钾样品,完全溶解于浓 溶液中,再加入足量亚铬酸钾
溶液中,再加入足量亚铬酸钾 反应后配成
反应后配成 溶液。
溶液。
②取上述溶液 于锥形瓶中,加入稀硫酸调至
于锥形瓶中,加入稀硫酸调至 ,用
,用 硫酸亚铁铵
硫酸亚铁铵 溶液滴定,消耗标准硫酸亚铁铵溶液
溶液滴定,消耗标准硫酸亚铁铵溶液 。
。
已知测定过程中发生如下反应: ,
, ,
, 。计算样品中
。计算样品中 的质量分数(写出计算过程)
的质量分数(写出计算过程)_______ 。
已知:
(1)氯气氧化氢氧化铁制备
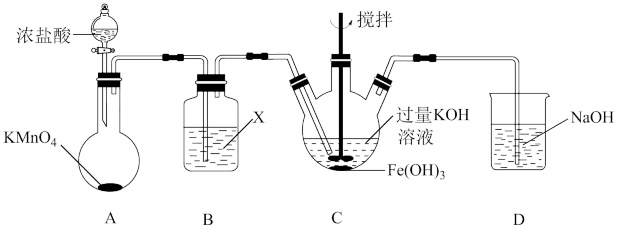
②装置C中得到紫色固体,主要反应的化学方程式为
(2)强碱性介质中,
(3)测定高铁酸钾样品的纯度
①称取
②取上述溶液
已知测定过程中发生如下反应:
21-22高三上·江苏南通·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网





