解答题-原理综合题 较难0.4 引用1 组卷364
以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
(1)N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解对环境保护有重要意义。碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步: (快反应)
(快反应)
第二步: (慢反应)
(慢反应)
第三步: (快反应)
(快反应)
实验表明,含碘时N2O分解速率方程 (k为速率常数)。下列表述正确的是___________
(k为速率常数)。下列表述正确的是___________
(2)汽车尾气中含有较多的氮氧化物和不完全燃烧的CO,汽车三元催化器可以实现降低氮氧化物的排放量。汽车尾气中的NO(g)和CO(g)在催化剂的作用下转化成两种无污染的气体:
 。
。
①已知:反应 ,若CO的燃烧热
,若CO的燃烧热 为-283.5kJ/mol,则
为-283.5kJ/mol,则 =
=___________ 。
②若在恒容的密闭容器中,充入2molCO和1molNO,下列选项中不能说明该反应已经达到平衡状态的是___________ 。
A.CO和NO的物质的量之比不变 B.混合气体的密度保持不变
C.混合气体的压强保持不变 D.
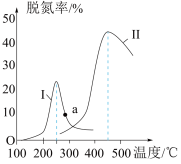
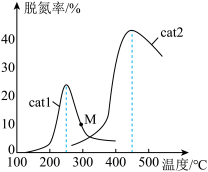
③研究表明氮氧化物的脱除率除了与还原剂、催化剂相关外,还取决于催化剂表面氧缺位的密集程度。以 (A、B均为过渡元素)为催化剂,用H2还原NO的机理如下:
(A、B均为过渡元素)为催化剂,用H2还原NO的机理如下:
第一阶段:B4+(不稳定)+H2→低价态的金属离子(还原前后催化剂中金属原子的个数不变)
第二阶段:Ⅰ. +□
+□
Ⅱ.
Ⅲ. □
□
Ⅳ.
Ⅴ. □
□
注:□表示催化剂表面的氧缺位,g表示气态,a表示吸附态
第一阶段用氢气还原B4+得到低价态的金属离子越多,第二阶段反应的速率越快,原因是___________ 。
(3) 与
与 之间存在反应
之间存在反应 。将定量的
。将定量的 放入恒容密闭容器中,测得其平衡转化率[
放入恒容密闭容器中,测得其平衡转化率[ ]随温度的变化如图所示。
]随温度的变化如图所示。
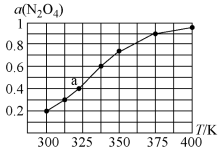
①图中a点对应温度下。已知N2O4的起始压强为108kPa,则该温度下反应的平衡常数Kp=___________ kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
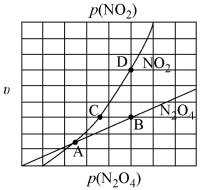
②在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系 ,
, ,其中k1、k2是与反应温度有关的常数。相应的速率、压强关系如图所示,一定温度下,k1、k2与平衡常数Kp的关系是k1=
,其中k1、k2是与反应温度有关的常数。相应的速率、压强关系如图所示,一定温度下,k1、k2与平衡常数Kp的关系是k1=___________ ,在图上标出的点中,能表示反应达到平衡状态的点为___________ (填字母代号)。
(1)N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解对环境保护有重要意义。碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步:
第二步:
第三步:
实验表明,含碘时N2O分解速率方程
| A.N2O分解反应中:k值与是否含碘蒸气有关 |
| B.第三步对总反应速率起决定作用 |
| C.第二步活化能比第三步小 |
| D.IO为反应的催化剂 |
①已知:反应
②若在恒容的密闭容器中,充入2molCO和1molNO,下列选项中不能说明该反应已经达到平衡状态的是
A.CO和NO的物质的量之比不变 B.混合气体的密度保持不变
C.混合气体的压强保持不变 D.
③研究表明氮氧化物的脱除率除了与还原剂、催化剂相关外,还取决于催化剂表面氧缺位的密集程度。以
第一阶段:B4+(不稳定)+H2→低价态的金属离子(还原前后催化剂中金属原子的个数不变)
第二阶段:Ⅰ.
Ⅱ.
Ⅲ.
Ⅳ.
Ⅴ.
注:□表示催化剂表面的氧缺位,g表示气态,a表示吸附态
第一阶段用氢气还原B4+得到低价态的金属离子越多,第二阶段反应的速率越快,原因是
(3)

①图中a点对应温度下。已知N2O4的起始压强为108kPa,则该温度下反应的平衡常数Kp=
②在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系

21-22高一上·辽宁沈阳·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网