解答题-工业流程题 适中0.65 引用1 组卷149
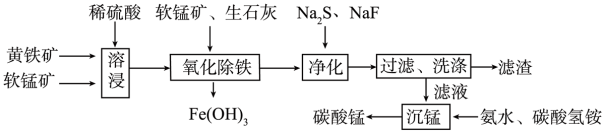
Ⅰ.磁性材料产业是21世纪各国竞相发展的高科技支柱产业之一,碳酸锰主要用于制备软磁铁氧体,工业上以软锰矿(主要成分为MnO2)和黄铁矿(主要成分为FeS2)为主要原料制备碳酸锰的主要工艺流程如下:

回答下列问题:
(1)为了提高溶浸工序中原料的浸出效率,采用的措施为_______ (写一条即可)
(2)溶浸过程中主要产生的离子为Fe3+、Mn2+、 ,请写出主要反应的离子方程式
,请写出主要反应的离子方程式_______ 。
(3)溶浸后的溶液中含有少量Fe2+、Cu2+、Ca2+,则“氧化除铁”过程中加入适量的软锰矿的目的是_______ 。
(4)“净化”工序的目的是除去溶液中的Cu2+、Ca2+等杂质,故滤渣主要成分是_______ (填化学式)和CaF2
(5)有人认为净化工序中使用NaF会引起污染,建议用(NH4)2CO3代替NaF,但是用(NH4)2CO3代替NaF的缺点是_______ 。
Ⅱ.工业上用“间接碘量法”测定高铁酸钾的纯度:用碱性KI溶液溶解1.00g K2FeO4样品,调节pH使高铁酸根全部被还原成亚铁离子,再调节pH为3~4,用1.0mol/L的Na2S2O3标准溶液作为滴定剂进行滴定(2Na2S2O3+I2=Na2S4O6+2NaI),淀粉作指示剂,装有Na2S2O3标准溶液的滴定管起始和终点读数如如图所示:
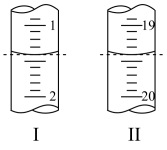
(6)消耗Na2S2O3标准溶液的体积为_______ mL。
(7)原样品中高铁酸钾的质量分数为_______ 。[M(K2FeO4)=198g/mol]
(8)若在配制Na2S2O3标准溶液的过程中定容时俯视刻度线,则导致所测高铁酸钾的质量分数_______ (填“偏高”、“偏低”或“无影响”)。

回答下列问题:
(1)为了提高溶浸工序中原料的浸出效率,采用的措施为
(2)溶浸过程中主要产生的离子为Fe3+、Mn2+、
(3)溶浸后的溶液中含有少量Fe2+、Cu2+、Ca2+,则“氧化除铁”过程中加入适量的软锰矿的目的是
(4)“净化”工序的目的是除去溶液中的Cu2+、Ca2+等杂质,故滤渣主要成分是
(5)有人认为净化工序中使用NaF会引起污染,建议用(NH4)2CO3代替NaF,但是用(NH4)2CO3代替NaF的缺点是
Ⅱ.工业上用“间接碘量法”测定高铁酸钾的纯度:用碱性KI溶液溶解1.00g K2FeO4样品,调节pH使高铁酸根全部被还原成亚铁离子,再调节pH为3~4,用1.0mol/L的Na2S2O3标准溶液作为滴定剂进行滴定(2Na2S2O3+I2=Na2S4O6+2NaI),淀粉作指示剂,装有Na2S2O3标准溶液的滴定管起始和终点读数如如图所示:

(6)消耗Na2S2O3标准溶液的体积为
(7)原样品中高铁酸钾的质量分数为
(8)若在配制Na2S2O3标准溶液的过程中定容时俯视刻度线,则导致所测高铁酸钾的质量分数
21-22高三上·宁夏石嘴山·阶段练习
类题推荐
磁性材料产业是21世纪各国竞相发展的高科技支柱产业之一,碳酸锰主要用于制备软磁铁氧体,工业上以软锰矿(主要成分为MnO2)和黄铁矿(主要成分为FeS2),为主要原料制备碳酸锰的主要工艺流程如下:
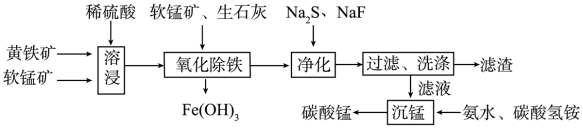
已知,几种金属离子沉淀的pH如下表,
回答下列问题:
(1)为了提高溶浸工序中原料的浸出效率,采用的措施不合理的有___________ 。
A.搅拌 B.适当升高温度 C.研磨矿石 D.加入足量的蒸馏水
(2)溶浸过程中主要产生的离子为Fe3、 Mn2 、SO ,请写出主要反应的离子方程式
,请写出主要反应的离子方程式___________ 。
(3) 溶浸后的溶液中含有少量Fe2、 Cu2、 Ca2+,则在加入生石灰调节溶液的pH从而使铁元素被完全沉淀前,加入适量的软锰矿的目的是___________ ,加入生石灰后调节溶液的pH的范围为___________ 。
(4) 净化工序的目的是除去溶液中的Cu2、 Ca2+等杂质,故滤渣主要成分是___________ (填化学式)和CaF2,若测得溶液中c(F)为0.01mol·L-1,则滤液中残留c(Ca2)为___________ mol·L-1 [已知:Ksp(CaF2)=1.46×10-10]。
(5) 有人认为净化空气中使用NaF会引起污染,建议用(NH4)2CO3代替NaF,但是用(NH4)2CO3代替NaF的缺点是___________ 。

已知,几种金属离子沉淀的pH如下表,
| 离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
| 完全沉淀的pH | 9.2 | 3.7 | 7.8 | 10.4 |
(1)为了提高溶浸工序中原料的浸出效率,采用的措施不合理的有
A.搅拌 B.适当升高温度 C.研磨矿石 D.加入足量的蒸馏水
(2)溶浸过程中主要产生的离子为Fe3、 Mn2 、SO
(3) 溶浸后的溶液中含有少量Fe2、 Cu2、 Ca2+,则在加入生石灰调节溶液的pH从而使铁元素被完全沉淀前,加入适量的软锰矿的目的是
(4) 净化工序的目的是除去溶液中的Cu2、 Ca2+等杂质,故滤渣主要成分是
(5) 有人认为净化空气中使用NaF会引起污染,建议用(NH4)2CO3代替NaF,但是用(NH4)2CO3代替NaF的缺点是
磁性材料产业是21世纪各国竞相发展的高科技支柱产业之一,作为信息产业和机电工业的重要基础功能材料,磁性材料广泛用于电子信息、军事技术等领域。碳酸锰主要用于制备软磁铁氧体,工业上以软锰矿(主要成分为MnO2)和黄铁矿(主要成分为FeS2)为主要原料制备碳酸锰的主要工艺流程如图:
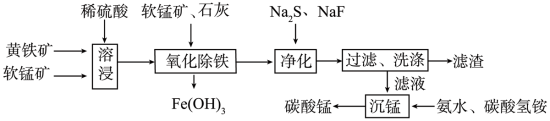
已知:几种金属离子沉淀的pH如表。
回答下列问题:
(1)为了提高溶浸工序中原料的浸出效率,采取的措施不合理的有____ 。
(2)溶浸过程中主要产生的金属阳离子为Fe3+、Mn2+,还含有少量Fe2+、Cu2+、Ca2+。在加入石灰调节溶液的pH前,先加入适量的软锰矿,其发生反应的离子方程式为____ ,加入石灰调节溶液pH的范围为____ 。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质,故滤渣主要是CaF2和____ (填化学式)。若测得滤液中c(F-)为0.001mol•L-1,则净化工序中Ca2+是否沉淀完全?____ (填“是”或“否”)[已知:Ksp(CaF2)=1.46×10-10]。
(4)有人认为净化工序中使用NaF会引起污染,建议用(NH4)2CO3代替NaF,但是用(NH4)2CO3代替NaF的缺点是____ 。
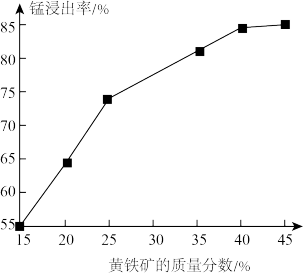
(5)如图为黄铁矿的质量分数对锰浸出率的影响,仅据图中信息,黄铁矿的质量分数应保持在____ %左右。

已知:几种金属离子沉淀的pH如表。
| Fe2+ | Fe3+ | Cu2+ | Mn2+ | |
| 开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
| 完全沉淀的pH | 9.2 | 3.7 | 7.8 | 10.4 |
回答下列问题:
(1)为了提高溶浸工序中原料的浸出效率,采取的措施不合理的有
| A.搅拌 | B.适当升高温度 | C.研磨矿石 | D.加入足量的水 |
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质,故滤渣主要是CaF2和
(4)有人认为净化工序中使用NaF会引起污染,建议用(NH4)2CO3代替NaF,但是用(NH4)2CO3代替NaF的缺点是
(5)如图为黄铁矿的质量分数对锰浸出率的影响,仅据图中信息,黄铁矿的质量分数应保持在

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网