解答题-原理综合题 适中0.65 引用1 组卷187
二甲醚(CH3OCH3)被称为“21世纪的清洁燃料”。以CO2、H2为原料制备二甲醚涉及的主要反应如下:
Ⅰ.2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H1=-122.5kJ·mol-1
CH3OCH3(g)+3H2O(g) △H1=-122.5kJ·mol-1
Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.1kJ·mol-1
CO(g)+H2O(g) △H2=+41.1kJ·mol-1
回答下列问题:
(1)反应2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)的△H=
CH3OCH3(g)+H2O(g)的△H=___________ 。该反应在___________ (填“较高温度”、“较低温度”或“任意温度”)下能自发进行。
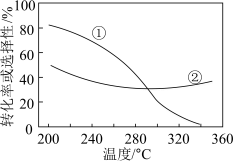
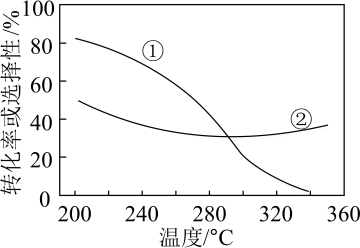
(2)在压强不变、CO2和H2的起始投料一定的条件下,发生反应Ⅰ、Ⅱ,实验测得CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图所示。
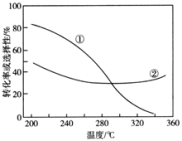
已知:CH3OCH3的选择性=
其中表示平衡时CH3OCH3的选择性的是曲线___________ (填“①”或“②”);投料一定时,为同时提高CO2的平衡转化率和平衡时CH3OCH3的选择性,应选择的反应条件为___________ ;
A.高温高压 B.低温高压 C.高温低压 D.低温低压
温度高于300℃时,曲线②随温度升高而升高的原因是___________ 。
(3)对于反应CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.1kJ·mol-1,反应速率=v正-v逆=k正p(CO2)·p(H2)-k逆p(CO)·p(H2O),其中k正、k逆分别为正、逆反应速率常数,p为气体的分压(分压=总压×物质的量分数)。
CO(g)+H2O(g) △H2=+41.1kJ·mol-1,反应速率=v正-v逆=k正p(CO2)·p(H2)-k逆p(CO)·p(H2O),其中k正、k逆分别为正、逆反应速率常数,p为气体的分压(分压=总压×物质的量分数)。
①升高温度,k正-k逆___________ (填“增大”、“减小”或“不变”);
②在TK、101kPa下,按照n(CO2)∶n(H2)=1∶1投料,CO2转化率为50%时, 逆=1.25
逆=1.25 正,计算用气体分压表示的平衡常数KP=
正,计算用气体分压表示的平衡常数KP=___________ 。
(4)下图为绿色“二甲醚燃料电池”的工作原理示意图。
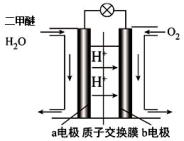
①a电极的电极反应式为___________ 。
②标准状况下,该电池每消耗11.2LO2,有___________ molH+向___________ 极移动(填“a”或“b”)。
Ⅰ.2CO2(g)+6H2(g)
Ⅱ.CO2(g)+H2(g)
回答下列问题:
(1)反应2CO(g)+4H2(g)
(2)在压强不变、CO2和H2的起始投料一定的条件下,发生反应Ⅰ、Ⅱ,实验测得CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图所示。

已知:CH3OCH3的选择性=
其中表示平衡时CH3OCH3的选择性的是曲线
A.高温高压 B.低温高压 C.高温低压 D.低温低压
温度高于300℃时,曲线②随温度升高而升高的原因是
(3)对于反应CO2(g)+H2(g)
①升高温度,k正-k逆
②在TK、101kPa下,按照n(CO2)∶n(H2)=1∶1投料,CO2转化率为50%时,
(4)下图为绿色“二甲醚燃料电池”的工作原理示意图。

①a电极的电极反应式为
②标准状况下,该电池每消耗11.2LO2,有
21-22高三上·广西·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网