解答题-原理综合题 适中0.65 引用1 组卷161
生物天然气是一种廉价的生物质能,它是由秸秆、杂草等废弃物经微生物发酵后产生的,其主要成分为CH4,甲烷燃烧时的能量变化如图所示。

(1)下列说法正确的是___________ (填序号)。
A.该反应的热化学方程式为
B.甲烷完全燃烧时化学能全部转化为热能
C.为充分利用甲烷,通入的空气越多越好
(2)用CH4催化还原 ,可消除氮氧化物的污染。
,可消除氮氧化物的污染。
已知:①
②
请写出 将
将 还原为
还原为 的热化学方程式
的热化学方程式___________ 。
(3)甲烷可用于生产合成水煤气,其反应为 ,已知断裂1mol相关化学键所需的能量如下表:
,已知断裂1mol相关化学键所需的能量如下表:
则a=___________ 。
(4) 在恒容密闭容器中,下列能作为合成氨反应达到平衡的依据的是
在恒容密闭容器中,下列能作为合成氨反应达到平衡的依据的是___________ 。
a. b.混合气体的密度保持不变
b.混合气体的密度保持不变
c.容器内压强保持不变 d. 、
、 、
、 的浓度之比为1∶3∶2
的浓度之比为1∶3∶2

(1)下列说法正确的是
A.该反应的热化学方程式为
B.甲烷完全燃烧时化学能全部转化为热能
C.为充分利用甲烷,通入的空气越多越好
(2)用CH4催化还原
已知:①
②
请写出
(3)甲烷可用于生产合成水煤气,其反应为
| 化学键 | H-H | O-H | C-H | |
| 键能/(kJ/mol) | 436 | 465 | a | 1076 |
(4)
a.
c.容器内压强保持不变 d.
21-22高二上·四川眉山·开学考试
知识点:盖斯定律与热化学方程式根据△H=反应物的键能之和-生成物的键能之和进行计算根据△H=生成物的总能量之和-反应物的总能量之和进行计算化学平衡状态的判断方法 答案解析 【答案】很抱歉,登录后才可免费查看答案和解析! 立即登录
类题推荐
水煤气的主要成分为一氧化碳和氢气,是重要的化工原料。
(1)一氧化碳与氢气反应过程的能量变化如图所示,反应的热化学方程式为__________ 。

I.已知下列反应:①CO(g)+ 0.5O2(g)=CO2(g) ΔH= -283.0kJ/mol, ②H2(g) + 0.5O2(g)= H2O(g) ΔH= -241.8kJ/mol, 分析下表可得到氢氧键的键能为____________ kJ·mol-1。
II.甲醇燃烧能释放出大量的热。则CH3OH(g)+1.5O2(g)= CO2(g)+ 2H2O(g)△H____ kJ·mol-1。
(2)甲烷与水蒸气反应可以制取水煤气,该反应为: CH4(g)+H2O(g) CO(g)+3H2(g)。
CO(g)+3H2(g)。
I.该反应的△S__________ 0 (填 “>”或“<” ),平衡常数的表达式为____________ 。下图是该反应在不同温度下CH4的转化率随时间变化的曲线,T1和T2温度下的平衡常数分别为K1、K2,则K1_____ K2 (填 “>” 、“<”或“=” )。

II.某温度下,将甲烷与水蒸气以物质的量之比1: 1置于恒容密闭容器中发生反应,能说明该反应已达到平衡的是________________ (填序号) .
A.体系的压强不发生变化 B.体系中碳元素的质量分数不变
C.混合气的密度保持不变 D. CO与H2的物质的量之比保持不变
III.若800°C时,该反应的平衡常数K=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为: c(CH4)=3.0mol·L-1、 c(H2O)=4.0mol·L-1、c(CO)= 2mol·L1、c(H2)=2mol·L-1,则此时该可逆反应的状态是_____ (填序号) 。
A.达到平衡 B.向正反应方向移动 C.向逆反应方向移动
(1)一氧化碳与氢气反应过程的能量变化如图所示,反应的热化学方程式为

I.已知下列反应:①CO(g)+ 0.5O2(g)=CO2(g) ΔH= -283.0kJ/mol, ②H2(g) + 0.5O2(g)= H2O(g) ΔH= -241.8kJ/mol, 分析下表可得到氢氧键的键能为
| 化学键 | H-H | O=O |
| 键能/kJ·mol-1 | 436 | 498 |
II.甲醇燃烧能释放出大量的热。则CH3OH(g)+1.5O2(g)= CO2(g)+ 2H2O(g)△H
(2)甲烷与水蒸气反应可以制取水煤气,该反应为: CH4(g)+H2O(g)
 CO(g)+3H2(g)。
CO(g)+3H2(g)。I.该反应的△S

II.某温度下,将甲烷与水蒸气以物质的量之比1: 1置于恒容密闭容器中发生反应,能说明该反应已达到平衡的是
A.体系的压强不发生变化 B.体系中碳元素的质量分数不变
C.混合气的密度保持不变 D. CO与H2的物质的量之比保持不变
III.若800°C时,该反应的平衡常数K=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为: c(CH4)=3.0mol·L-1、 c(H2O)=4.0mol·L-1、c(CO)= 2mol·L1、c(H2)=2mol·L-1,则此时该可逆反应的状态是
A.达到平衡 B.向正反应方向移动 C.向逆反应方向移动
CH4、CH3OH(甲醇)既是重要的化工原料,又是未来重要的能源物质。
(1)将1.0molCH4和2.0molH2O(g)通入容积为2L的反应室,在一定条件下发生反应CH4(g)+H2O(g) CO(g)+3H2(g),测得在5min时达到平衡,CH4的平衡转化率为40%。则0~5min内,用H2O表示该反应的平均反应速率为
CO(g)+3H2(g),测得在5min时达到平衡,CH4的平衡转化率为40%。则0~5min内,用H2O表示该反应的平均反应速率为___ 。
(2)一定条件下,将1.0molCH4与2.0molH2O(g)充入密闭容器中发生反应CH4(g)+H2O(g) CH3OH(g)+H2(g),下列措施可以提高化学反应速率的是
CH3OH(g)+H2(g),下列措施可以提高化学反应速率的是___ (填选项序号)。
a.恒容条件下充入He b.增大体积
c.升高温度 d.投入更多的H2O(g)
(3)在恒容条件下进行反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),则下列实验事实可以作为判断该反应达到平衡状态标志的是
CH3OH(g)+H2O(g),则下列实验事实可以作为判断该反应达到平衡状态标志的是___ (填选项序号)。
a.消耗1molCO2同时生成1molCH3OH
b.容器内压强保持不变
c.混合气体的密度保持不变
d.CH3OH(g)的浓度保持不变
(4)已知断裂几种化学键要吸收的能量如下:
16gCH4在O2中完全燃烧生成气态CO2和气态水时___ (填“吸收”或“放出”)约___ kJ热量。
(5)以KOH为电解质的甲醇—空气燃料电池是一种高效、轻污染的车载电池,其工作原理如图。回答下列问题:
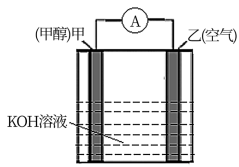
①该原电池的正极是___ (填“甲”或“乙”)
②负极的电极反应式___ 。
(1)将1.0molCH4和2.0molH2O(g)通入容积为2L的反应室,在一定条件下发生反应CH4(g)+H2O(g)
(2)一定条件下,将1.0molCH4与2.0molH2O(g)充入密闭容器中发生反应CH4(g)+H2O(g)
a.恒容条件下充入He b.增大体积
c.升高温度 d.投入更多的H2O(g)
(3)在恒容条件下进行反应CO2(g)+3H2(g)
a.消耗1molCO2同时生成1molCH3OH
b.容器内压强保持不变
c.混合气体的密度保持不变
d.CH3OH(g)的浓度保持不变
(4)已知断裂几种化学键要吸收的能量如下:
| 化学键 | C—H | O=O | C=O | H—O |
| 断裂1mol键吸收的能量/kJ | 415 | 497 | 745 | 463 |
(5)以KOH为电解质的甲醇—空气燃料电池是一种高效、轻污染的车载电池,其工作原理如图。回答下列问题:

①该原电池的正极是
②负极的电极反应式
(1)500℃时,在2L密闭容器内发生2SO2(g)+O2(g) 2SO3(g)的反应,其中n(SO2)随时间的变化如下表:
2SO3(g)的反应,其中n(SO2)随时间的变化如下表:
①在第5s时,SO2的转化率为__________________ 。
②能说明该反应已达到平衡状态的是_________________ 。
a. v(SO2)=v(O2) b.混合气体中SO2的体积分数保持不变
c.v逆(SO2)=2v正(O2) d.容器内密度保持不变
(2)硅是信息技术的关键材料。
用H2还原气态SiCl4制得28g硅的反应热为__________________ 。
(3)目前,消除氮氧化物污染有多种方法。
用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式_______ 。
 2SO3(g)的反应,其中n(SO2)随时间的变化如下表:
2SO3(g)的反应,其中n(SO2)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(SO2)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
①在第5s时,SO2的转化率为
②能说明该反应已达到平衡状态的是
a. v(SO2)=v(O2) b.混合气体中SO2的体积分数保持不变
c.v逆(SO2)=2v正(O2) d.容器内密度保持不变
(2)硅是信息技术的关键材料。
| 化学键 | H-H | Si-Cl | Si-Si | H-Cl |
| E/kJ·mol-1 | 436.0 | 360 | 176 | 431.8 |
用H2还原气态SiCl4制得28g硅的反应热为
(3)目前,消除氮氧化物污染有多种方法。
用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


