解答题-原理综合题 较难0.4 引用4 组卷363
合成气是一种重要的化工原料气,甲烷、二氧化碳自热重整制合成气的主要反应有:
Ⅰ.CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH1=+247.3kJ·mol-1
2CO(g)+2H2(g) ΔH1=+247.3kJ·mol-1
Ⅱ.CH4(g)+H2O(g) CO(g)+3H2(g) ΔH2=+206.1kJ·mol-1
CO(g)+3H2(g) ΔH2=+206.1kJ·mol-1
Ⅲ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
回答下列问题:
(1)ΔH3=___________ kJ·mol-1。
(2)一定条件下,向VL恒容密闭容器中通入2molCH4(g)、1molCO2(g)、1molH2O(g)发生上述反应,达到平衡时,容器中CH4(g)为amol,CO2(g)为bmol,H2O(g)为cmol,此时CO(g)的浓度为___________ mol·L-1,反应Ⅲ的平衡常数为___________ 。(用含a、b、c、V的代数式表示)
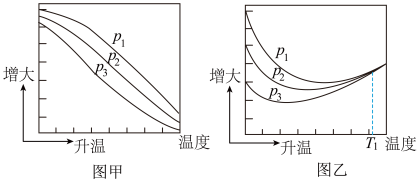
(3)不同温度下,向VL密闭容器中按照n(CO2):n(CH4):n(H2O)=1:1:1投料,实验测得平衡时n(H2):n(CO)随温度的变化关系如图所示:
①压强p1、p2、p3由大到小的顺序为___________ ,判断的依据是___________ 。
②压强为p2时,随着温度升高,n(H2):n(CO)先增大后减小。解释温度Tm前后,随着温度升高n(H2):n(CO)变化的原因分别是___________ 。
(4)通过电化学方法可有效实现以CO2和水为原料合成甲酸,其原理示意图如下:
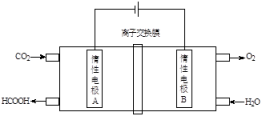
则A极的电极反应式为___________ 。
Ⅰ.CH4(g)+CO2(g)
Ⅱ.CH4(g)+H2O(g)
Ⅲ.CO2(g)+H2(g)
回答下列问题:
(1)ΔH3=
(2)一定条件下,向VL恒容密闭容器中通入2molCH4(g)、1molCO2(g)、1molH2O(g)发生上述反应,达到平衡时,容器中CH4(g)为amol,CO2(g)为bmol,H2O(g)为cmol,此时CO(g)的浓度为
(3)不同温度下,向VL密闭容器中按照n(CO2):n(CH4):n(H2O)=1:1:1投料,实验测得平衡时n(H2):n(CO)随温度的变化关系如图所示:

①压强p1、p2、p3由大到小的顺序为
②压强为p2时,随着温度升高,n(H2):n(CO)先增大后减小。解释温度Tm前后,随着温度升高n(H2):n(CO)变化的原因分别是
(4)通过电化学方法可有效实现以CO2和水为原料合成甲酸,其原理示意图如下:

则A极的电极反应式为
21-22高三上·河北唐山·开学考试
类题推荐
合成气是一种重要的化工原料气,主要组分为CO和H2。用甲烷、二氧化碳自热重整可制备合成气,反应原理如下:
反应I:CH4(g)+2O2(g) CO2(g)+2H2O(g) △H1=-820.6kJ·mol-1
CO2(g)+2H2O(g) △H1=-820.6kJ·mol-1
反应II:CH4(g)+CO2(g) 2CO(g)+2H2(g) △H2=+247.1kJ·mol-1
2CO(g)+2H2(g) △H2=+247.1kJ·mol-1
反应III:CH4(g)+H2O(g) CO(g)+3H2(g) △H3=+205.9kJ·mol-1
CO(g)+3H2(g) △H3=+205.9kJ·mol-1
反应IV:CO2(g)+H2(g) CO(g)+H2O(g) △H4
CO(g)+H2O(g) △H4
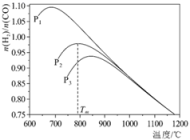
不同温度下,向体积为VL的含少量O2的恒压容器按照n(CO2):n(CH4)=1投料,实验测得不同压强下平衡时 随温度的变化关系如图所示。下列说法正确的是
随温度的变化关系如图所示。下列说法正确的是

反应I:CH4(g)+2O2(g)
反应II:CH4(g)+CO2(g)
反应III:CH4(g)+H2O(g)
反应IV:CO2(g)+H2(g)
不同温度下,向体积为VL的含少量O2的恒压容器按照n(CO2):n(CH4)=1投料,实验测得不同压强下平衡时

| A.△H4=-41.2kJ·mol-1 |
| B.某温度下,反应II的平衡常数随压强增大而减小 |
| C.由图可知,p1>p2>p3 |
| D.压强为p2时,T>Tm后,升高温度对反应IV的促进作用更大 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网