解答题-实验探究题 适中0.65 引用2 组卷323
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。
已知:①K2FeO4为紫色固体,微溶于KOH溶液
②在碱性条件下,次氯酸盐(MClO)可将Fe(OH)3氧化成高铁酸盐(M2FeO4)。
④K2FeO4具有强氧化性,在酸性或中性溶液中迅速产生O2,在碱性溶液中较稳定。某学习小组设计了下面的实验制备K2FeO4并探究其性质。
(1)K2FeO4的制备
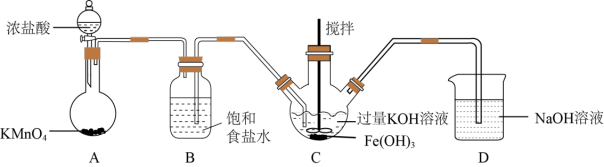
该小组用如图所示装置制备K2FeO4(夹持装置路)。
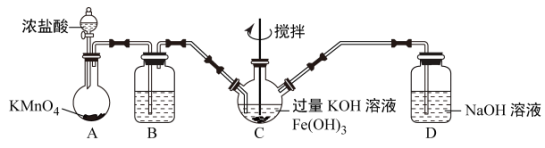
①K2FeO4中铁元素的化合价为___ 价。
②以上装置图中有一处明显的错误请你帮助指出来:___ 。
③A装置作用是产生黄绿色氯气(Cl2),写出A中发生反应的离子方程式__ 。
④C中发生的反应有Cl2+2KOH=KCl+KClO+H2O,还有生成K2FeO4的反应。写出得到K2FeO4的化学方程式为___ 。
(2)性质探究
用KOH溶液充分洗涤C中所得固体得到固体物质K2FeO4
①絮凝实验:甲同学取少量K2FeO4加入浑的泥浆水中,发现产生气体,搅拌,浑浊的泥浆水很快澄清。查阅资料此时发生反应的离子方程式为:4FeO +10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-,请结合方程式,说明K2FeO4的净水原理:
+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-,请结合方程式,说明K2FeO4的净水原理:___ 。
②乙同学取少量K2FeO4,向其中滴入稀盐酸发现产生黄绿色气体。产生黄绿色气体的原因可能是___ 。(用文字描述)
已知:①K2FeO4为紫色固体,微溶于KOH溶液
②在碱性条件下,次氯酸盐(MClO)可将Fe(OH)3氧化成高铁酸盐(M2FeO4)。
④K2FeO4具有强氧化性,在酸性或中性溶液中迅速产生O2,在碱性溶液中较稳定。某学习小组设计了下面的实验制备K2FeO4并探究其性质。
(1)K2FeO4的制备
该小组用如图所示装置制备K2FeO4(夹持装置路)。

①K2FeO4中铁元素的化合价为
②以上装置图中有一处明显的错误请你帮助指出来:
③A装置作用是产生黄绿色氯气(Cl2),写出A中发生反应的离子方程式
④C中发生的反应有Cl2+2KOH=KCl+KClO+H2O,还有生成K2FeO4的反应。写出得到K2FeO4的化学方程式为
(2)性质探究
用KOH溶液充分洗涤C中所得固体得到固体物质K2FeO4
①絮凝实验:甲同学取少量K2FeO4加入浑的泥浆水中,发现产生气体,搅拌,浑浊的泥浆水很快澄清。查阅资料此时发生反应的离子方程式为:4FeO
②乙同学取少量K2FeO4,向其中滴入稀盐酸发现产生黄绿色气体。产生黄绿色气体的原因可能是
20-21高一下·江苏南京·阶段练习
类题推荐
实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)K2FeO4作为高效、多功能水处理剂的原因是______________________________ 。
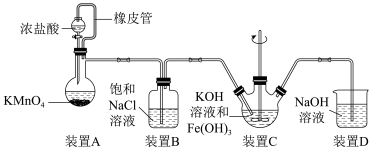
(2)制备K2FeO4(夹持装置略)

①A为氯气发生装置。A中反应方程式是_____________________________ 。
②该装置有明显不合理设计,如何改进?____________________________ 。
③改进后,B中得到紫色固体和溶液。B中Cl2发生的反应有3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O,另外还有____________________________ 。
(3)探究K2FeO4的性质(改进后的实验)
①取B中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
a.由方案Ⅰ中溶液变红可知a中含有______ 离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由_________________________ 产生(用方程式表示)。
b.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是______________ 。
②根据K2FeO4的制备实验和方案Ⅱ实验表明Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是_____________ 。
资料:K2FeO4为紫色固体,微溶于KOH溶液;在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)K2FeO4作为高效、多功能水处理剂的原因是
(2)制备K2FeO4(夹持装置略)

①A为氯气发生装置。A中反应方程式是
②该装置有明显不合理设计,如何改进?
③改进后,B中得到紫色固体和溶液。B中Cl2发生的反应有3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O,另外还有
(3)探究K2FeO4的性质(改进后的实验)
①取B中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案Ⅱ | 用KOH溶液充分洗涤B中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
a.由方案Ⅰ中溶液变红可知a中含有
b.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是
②根据K2FeO4的制备实验和方案Ⅱ实验表明Cl2和
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网