解答题-实验探究题 适中0.65 引用1 组卷138
葡萄糖酸锌[Zn(C6H11O7)2]是一种有机补锌剂,广泛应用于食药领域。已知葡萄糖酸锌能溶于水,易溶于热水,不溶于乙醇,稍高于100℃即开始分解。某小组由葡萄糖制备葡萄糖酸锌的实验步骤如下:
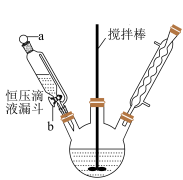
Ⅰ.制备葡萄糖酸(C6H12O7):60℃水浴下,向一定体积葡萄糖溶液中滴入1%溴水至略过量,保温5min。
Ⅱ.制备葡萄糖酸钙[Ca(C6H11O7)2]:将略过量高纯CaCO3粉末缓慢加入上述溶液,在水浴中振荡,直至无气泡产生。过滤,冷却并加入等体积乙醇,产生沉淀。过滤,用乙醇洗涤固体,溶水待用。
Ⅲ.制备葡萄糖酸锌粗品:在90℃水浴、搅拌下,向ZnSO4溶液中分批加入葡萄糖酸钙溶液。趁热过滤,向滤液中加入无水乙醇并冷却析晶,过滤。
请回答下列问题:
(1)步骤Ⅰ中发生反应的化学方程式为___________ 。
(2)步骤Ⅲ中反应控温在90℃的原因为___________ 。
(3)步骤Ⅲ中向滤液中加入无水乙醇的作用是___________ 。
(4)高纯CaCO3的制备。请设计以石灰石(含少量铁的氧化物,其他杂质不考虑)、盐酸,碳酸铵溶液为原料制备高纯碳酸钙的实验方案:边搅拌边将石灰石粉末分批加入稀盐酸中,至不再有气泡产生,___________ ,得到高纯CaCO3。(实验中须使用的试剂有:氨水、H2O2溶液、HNO3溶液、AgNO3溶液)
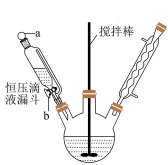
Ⅰ.制备葡萄糖酸(C6H12O7):60℃水浴下,向一定体积葡萄糖溶液中滴入1%溴水至略过量,保温5min。
Ⅱ.制备葡萄糖酸钙[Ca(C6H11O7)2]:将略过量高纯CaCO3粉末缓慢加入上述溶液,在水浴中振荡,直至无气泡产生。过滤,冷却并加入等体积乙醇,产生沉淀。过滤,用乙醇洗涤固体,溶水待用。
Ⅲ.制备葡萄糖酸锌粗品:在90℃水浴、搅拌下,向ZnSO4溶液中分批加入葡萄糖酸钙溶液。趁热过滤,向滤液中加入无水乙醇并冷却析晶,过滤。
请回答下列问题:
(1)步骤Ⅰ中发生反应的化学方程式为
(2)步骤Ⅲ中反应控温在90℃的原因为
(3)步骤Ⅲ中向滤液中加入无水乙醇的作用是
(4)高纯CaCO3的制备。请设计以石灰石(含少量铁的氧化物,其他杂质不考虑)、盐酸,碳酸铵溶液为原料制备高纯碳酸钙的实验方案:边搅拌边将石灰石粉末分批加入稀盐酸中,至不再有气泡产生,
21-22高三上·江苏南通·开学考试
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网