解答题-原理综合题 适中0.65 引用1 组卷128
丙烯是重要的化工原料,利用丙烷制备丙烯通常有三种方法。
方法一:丙烷直接脱氢法
(1)丙烷直接脱氢的主要反应为
 。
。 、
、 下向装有催化剂的恒压密闭容器中以
下向装有催化剂的恒压密闭容器中以 投料发生反应。平衡时,丙烷的转化率45%。用分压表示该反应的平衡常数
投料发生反应。平衡时,丙烷的转化率45%。用分压表示该反应的平衡常数
___________ ;增大 的值可提高丙烷的平衡转化率,解释其原因为
的值可提高丙烷的平衡转化率,解释其原因为___________ 。
方法二:丙烷氧化脱氢法
(2)丙烷氧化脱氢制丙烯时,主要发生反应
 。已知:氢气的燃烧热
。已知:氢气的燃烧热 为
为 ;水的汽化热
;水的汽化热 为
为
 ;结合
;结合 ,可计算
,可计算
___________ 。
方法三:丙烷与 耦合法
耦合法
(3)丙烷与 耦合法制丙烯时,主要发生如下反应:
耦合法制丙烯时,主要发生如下反应:
i.
ii.
iii.
iv.
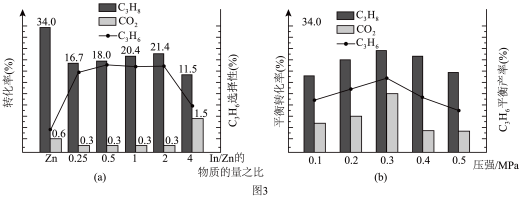
在 时,将
时,将 和
和 按体积比为1:1充入一恒压密闭容器中进行反应,实验测得体系中
按体积比为1:1充入一恒压密闭容器中进行反应,实验测得体系中 、
、 的转化率和
的转化率和 的选择性、
的选择性、 的平衡产率随催化剂组成和压强的变化分别如图3和图4所示。
的平衡产率随催化剂组成和压强的变化分别如图3和图4所示。
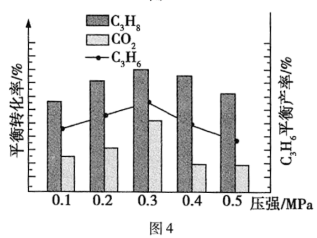
已知: 的选择性越高,副产物的含量越低。
的选择性越高,副产物的含量越低。
耦合法制丙烯适宜选择的生产条件为___________ ;随压强增大 的平衡产率先增大后减小的原因为
的平衡产率先增大后减小的原因为___________ 。
方法一:丙烷直接脱氢法
(1)丙烷直接脱氢的主要反应为
方法二:丙烷氧化脱氢法
(2)丙烷氧化脱氢制丙烯时,主要发生反应
方法三:丙烷与
(3)丙烷与
i.
ii.
iii.
iv.
在


已知:
耦合法制丙烯适宜选择的生产条件为
21-22高三上·山西运城·开学考试
类题推荐
丙烯是重要的化工原料,目前生产丙烯主要有丙烷脱氢、丙烷与二氧化碳耦合、电解等技术。
方法一:丙烷直接脱氢法制丙烯
已知:CH3CH2CH3(g)+5O2(g)=3CO2(g)+4H2O(1) △H=akJ·mol-1
2CH3CH=CH2(g)+9O2(g)=6CO2(g)+6H2O(1) △H=bkJ·mol-1
2H2(g)+O2(g)=H2O(1) △H=ckJ·mol-1
(1)写出丙烷脱氢生成丙烯和氢气的热化学方程式:____ 。
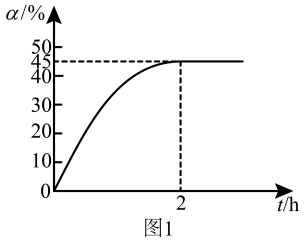
(2)600℃、0.4MPa下,向装有催化剂的恒压密闭容器中,以 =1投料,发生丙烷脱氢生成丙烯的反应,丙烷的转化率(α)随时间(t)变化的曲线如图所示:
=1投料,发生丙烷脱氢生成丙烯的反应,丙烷的转化率(α)随时间(t)变化的曲线如图所示:
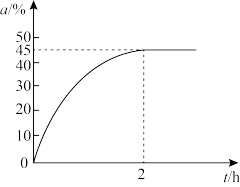
则该体系达到平衡状态的标志为____ (填选项字母)。
(3)平衡时水的分压约为___ ,增大 的值可提高丙烷的转化率,解释其原因:
的值可提高丙烷的转化率,解释其原因:___ 。
方法二:丙烷与二氧化碳耦合法制丙烯
(4)丙烷与CO2耦合法制丙烯时,主要发生如下反应:
①C3H8(g) C3H6(g)+H2(g)
C3H6(g)+H2(g)
②C3H8(g) C2H4(g)+CH4(g)
C2H4(g)+CH4(g)
③3CO2(g)+9H2(g) C3H6(g)+6H2O(g)
C3H6(g)+6H2O(g)
④CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
在580℃时,将C3H8和CO2按体积比1:1充入一恒压密闭容器中进行反应,实验测得体系中C3H8(g)、CO2(g)的转化率和C3H6(g)的选择性、C3H6(g)的产率随催化剂组成和压强的变化分别如图甲和图乙所示:
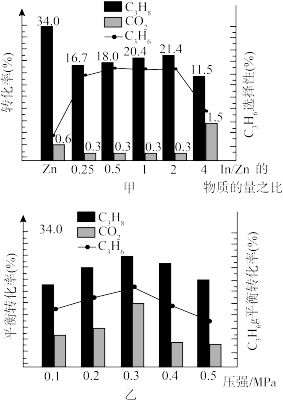
已知:C3H6(g)的选择性越高,副产物的含量越低。
耦合法制丙烯适宜选择的生产条件为____ ,随压强增大C3H6的平衡产率先增大后减小的原因为___ 。
方法三:电解法制丙烯
(5)在酸性电解质溶液中,以惰性材料作电极,将 转化为丙烯的原理如图所示:
转化为丙烯的原理如图所示:
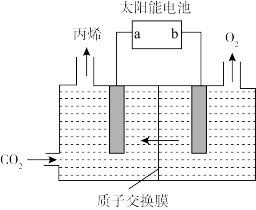
①太阳能电池的负极是____ (填“a”或“b”);
②生成丙烯的电极反应式是____ 。
方法一:丙烷直接脱氢法制丙烯
已知:CH3CH2CH3(g)+5O2(g)=3CO2(g)+4H2O(1) △H=akJ·mol-1
2CH3CH=CH2(g)+9O2(g)=6CO2(g)+6H2O(1) △H=bkJ·mol-1
2H2(g)+O2(g)=H2O(1) △H=ckJ·mol-1
(1)写出丙烷脱氢生成丙烯和氢气的热化学方程式:
(2)600℃、0.4MPa下,向装有催化剂的恒压密闭容器中,以

则该体系达到平衡状态的标志为
| A.单位时间内消耗C3H8(g)的物质的量等于生成H2(g)的物质的量 |
| B.体系中气体的密度不再改变 |
| C.单位体积内气体的分子数不再改变 |
| D.H2O(g)的分压不再改变 |
方法二:丙烷与二氧化碳耦合法制丙烯
(4)丙烷与CO2耦合法制丙烯时,主要发生如下反应:
①C3H8(g)
②C3H8(g)
③3CO2(g)+9H2(g)
④CO2(g)+H2(g)
在580℃时,将C3H8和CO2按体积比1:1充入一恒压密闭容器中进行反应,实验测得体系中C3H8(g)、CO2(g)的转化率和C3H6(g)的选择性、C3H6(g)的产率随催化剂组成和压强的变化分别如图甲和图乙所示:

已知:C3H6(g)的选择性越高,副产物的含量越低。
耦合法制丙烯适宜选择的生产条件为
方法三:电解法制丙烯
(5)在酸性电解质溶液中,以惰性材料作电极,将

①太阳能电池的负极是
②生成丙烯的电极反应式是
丙烯是重要的化工原料,目前生产丙烯主要有丙烷脱氢、丙烷与二氧化碳耦合等技术。
方法一:丙烷在催化剂作用下直接脱氢法制丙烯
已知:主反应 Ⅰ:C3H8(g) C3H6(g)+H2(g)ΔH1>0
C3H6(g)+H2(g)ΔH1>0
副反应 Ⅱ:C3H8(g) C2H4(g)+CH4(g)
C2H4(g)+CH4(g)
(1)反应Ⅰ自发进行的条件___________ 。
(2)一定温度下,向1L恒容密闭容器中通入0.6mol C3H8,压强为0.75MPa,反应后测得各组分的平衡压强(即组分的物质的量分数×总压)为:p(C3H8)=0.5MPa、p(CH4)=0.075MPa,则该温度下,用物质的量浓度表示反应Ⅰ的平衡常数Kc的数值为___________ 。
(3)下列说法正确的是___________
方法二:丙烷与二氧化碳耦合法制丙烯
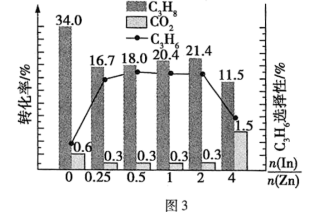
(4)以In/Zn作为催化剂,丙烷与二氧化碳可通过耦合法制丙烯,主要发生如下反应:
Ⅰ:C3H8(g) C3H6(g)+H2(g)
C3H6(g)+H2(g)
Ⅱ:C3H8(g) C2H4(g)+CH4(g)
C2H4(g)+CH4(g)
Ⅲ:CO2(g)+9H2(g) C3H6(g)+6H2O(g)
C3H6(g)+6H2O(g)
Ⅳ:CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
在580℃时,将C3H8和CO2按体积比1:1充入一恒压密闭容器中进行反应,实验测得体系中C3H8(g)、CO2(g)的转化率和C3H6(g)的选择性随催化剂组成变化如图甲,体系中C3H8(g)、CO2(g)的平衡转化率和C3H6(g)的平衡产率随压强变化如图乙。
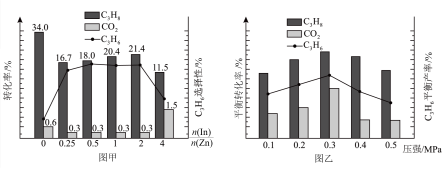
已知:C3H6(g)的选择性越高,副产物的含量越低。
耦合法制丙烯适宜选择的生产条件为___________ ,随压强增大C3H6(g)的平衡产率先增大后减小的原因为___________ 。
方法一:丙烷在催化剂作用下直接脱氢法制丙烯
已知:主反应 Ⅰ:C3H8(g)
副反应 Ⅱ:C3H8(g)
(1)反应Ⅰ自发进行的条件
(2)一定温度下,向1L恒容密闭容器中通入0.6mol C3H8,压强为0.75MPa,反应后测得各组分的平衡压强(即组分的物质的量分数×总压)为:p(C3H8)=0.5MPa、p(CH4)=0.075MPa,则该温度下,用物质的量浓度表示反应Ⅰ的平衡常数Kc的数值为
(3)下列说法正确的是___________
| A.通过充入惰性气体增大压强,不改变反应Ⅰ的反应速率 |
| B.恒温恒压条件下,ΔH1保持不变,说明反应Ⅰ达到平衡状态 |
| C.若只发生反应Ⅰ,恒压条件下,向原料气中掺入水蒸气,可增大反应的平衡常数,提高丙烯的产率 |
| D.已知高温条件下,C-C键比C-H键更易断裂,则制备丙烯应选择较低温度下的高效催化剂 |
方法二:丙烷与二氧化碳耦合法制丙烯
(4)以In/Zn作为催化剂,丙烷与二氧化碳可通过耦合法制丙烯,主要发生如下反应:
Ⅰ:C3H8(g)
Ⅱ:C3H8(g)
Ⅲ:CO2(g)+9H2(g)
Ⅳ:CO2(g)+H2(g)
在580℃时,将C3H8和CO2按体积比1:1充入一恒压密闭容器中进行反应,实验测得体系中C3H8(g)、CO2(g)的转化率和C3H6(g)的选择性随催化剂组成变化如图甲,体系中C3H8(g)、CO2(g)的平衡转化率和C3H6(g)的平衡产率随压强变化如图乙。

已知:C3H6(g)的选择性越高,副产物的含量越低。
耦合法制丙烯适宜选择的生产条件为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网