解答题-结构与性质 适中0.65 引用1 组卷118
铝、锌、铁在人类生产和生活中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Fe2+电子排布式为___________ ,Zn的基态原子能级最高的电子的电子云轮廓图形状为___________ 。
(2)已知Al的第一电离能为578kJ·mol-1、Mg的第一电离能为740kJ·mol-1,请解释Mg的第一电离能比Al大的原因___________ 。
(3)Zn2+可形成[Zn(NH3)6]SO4络合物,1mol[Zn(NH3)6]2+配离子中含σ键___________ mol,其阴离子中心原子的杂化方式是___________ ,NH3的沸点高于PH3的原因是___________ 。
(4)已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示:
请根据原子结构中外围电子排布推测Sc3+、Zn2+的水合离子为无色的原因:___________ 。
(5)Fe晶体中堆积方式为体心立方堆积,则这种堆积方式的空间利用率为___________ ,这种堆积方式的配位数为___________ 。
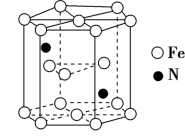
(6)Fe和N可组成一种过渡金属氮化物,其晶胞如图所示。六棱柱底边边长为xnm,高为ynm,NA为阿伏加德罗常数的值,则晶胞的密度为___________ g·cm-3(列出计算式即可)。
(1)Fe2+电子排布式为
(2)已知Al的第一电离能为578kJ·mol-1、Mg的第一电离能为740kJ·mol-1,请解释Mg的第一电离能比Al大的原因
(3)Zn2+可形成[Zn(NH3)6]SO4络合物,1mol[Zn(NH3)6]2+配离子中含σ键
(4)已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示:
| 离子 | Sc3+ | Cr3+ | Fe2+ | Zn2+ |
| 水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
(5)Fe晶体中堆积方式为体心立方堆积,则这种堆积方式的空间利用率为
(6)Fe和N可组成一种过渡金属氮化物,其晶胞如图所示。六棱柱底边边长为xnm,高为ynm,NA为阿伏加德罗常数的值,则晶胞的密度为

20-21高三下·甘肃嘉峪关·阶段练习
类题推荐
第四、五周期过渡元素单质及其化合物在生活、生产中有广泛应用。回答下列问题:
(1)Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+的配位数是___________ ,配位体NH3的空间构型为___________ 。
(2)NiO的晶体结构如图所示,其中离子坐标参数A为(0,0,0),B为(1,1,0),则C原子的坐标参数为___________ 。

(3)钴盐与NO 形成的配离子[Co(NO2)6]3-可用于检验K+的存在。K3[Co(NO2)6]中存在的作用力有
形成的配离子[Co(NO2)6]3-可用于检验K+的存在。K3[Co(NO2)6]中存在的作用力有___________ (填标号)。
a.σ键b.π键c.离子键d.范德华力e.配位键
(4)已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示。
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因:___________ 。
(5)①从磷钇矿中可提取稀土元素钇(Y),某磷钇矿的晶胞如图所示,该磷钇矿的化学式为___________ 。
②已知晶胞参数为anm和cnm,阿伏加德罗常数的值为NA,则该磷钇矿的ρ为___________ g·cm-3(列出计算式,用含a、c的代数式表示)。

(1)Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+的配位数是
(2)NiO的晶体结构如图所示,其中离子坐标参数A为(0,0,0),B为(1,1,0),则C原子的坐标参数为

(3)钴盐与NO
a.σ键b.π键c.离子键d.范德华力e.配位键
(4)已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示。
| 离子 | Sc3+ | Cr3+ | Fe2+ | Zn2+ |
| 水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
(5)①从磷钇矿中可提取稀土元素钇(Y),某磷钇矿的晶胞如图所示,该磷钇矿的化学式为
②已知晶胞参数为anm和cnm,阿伏加德罗常数的值为NA,则该磷钇矿的ρ为

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网