解答题-原理综合题 适中0.65 引用1 组卷300
氯气是一种重要的化工原料。
(1)由氧化物经氯化作用生成氯化物是工业生产氯化物的常用方法,例如,工业上,常采用“加碳氯化”的方法以高钛渣(主要成分为TiO2)为原料生产TiCl4.已知:
TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) ΔH1=+175.4kJ·mol-1;KI=3.4×10-29
2C(s)+O2(g)=2CO(g) ΔH2=-220.9kJ·mol-1;KII=1.2×1048
沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:_______ 。结合数据说明 氯化过程中加碳的理由_______ 。
(2)Cl2合成有机物时会产生副产物HCl。4HCl+O2 2Cl2+2H2O,可实现氯的循环利用。
2Cl2+2H2O,可实现氯的循环利用。
①若该反应在体积不变的密闭容器中发生,当反应达平衡时,下列叙述正确的是_______
a.v(HCl)=2v(Cl2)
b.4v正(HCl)=v逆(O2)
c.又加入1molO2,达新平衡时,HCl的转化率增大
d.分离出H2O,达新平衡时,v正(HCl)增大
②下图是该反应两种投料比[n(HCl):n(O2)分别为4:1和2:1]下,反应温度对HCl平衡转化率影响的曲线。下列叙述正确的是_______ 。
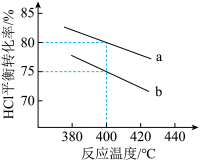
a.该反应的正反应是放热反应
b.其他条件不变,升高温度,平衡常数K值增大
c.若平衡常数K值变大,达新平衡前v逆始终减小
d.若平衡常数K值变大,则平衡向正反应方向移动
(3)在一定温度下,氯气溶于水的过程及其平衡常数为:
Cl2(g)⇌Cl2(aq) K1=c(Cl2)/p
Cl2(aq)+H2O(l)⇌H+(aq)+Cl-(aq)+HClO(aq) K2
其中p为Cl2(g)的平衡压强,c(Cl2)为Cl2在水溶液中的平衡浓度。
①Cl2(g)⇌Cl2(aq)的焓变ΔH1_______ 0(填”>”、“=”或“<”)。
②平衡常数K2的表达式为K2=_______ 。
③氯气在水中的溶解度(以物质的量浓度表示)为c,则c=_______ 。(用平衡压强p和上述平衡常数表示,忽略HClO的电离)
(4)在一定温度下,以I2为催化剂,氯苯和Cl2在CS2中发生平行反应,分别生成邻二氯苯和对二氯苯,两产物浓度之比与反应时间无关。反应物起始浓度均为0.5mol·L-1,反应30min测得氯苯15%转化为邻二氯苯,25%转化为对二氯苯。保持其他条件不变,若要提高产物中邻二氯苯的比例,可采用的措施是___。
(1)由氧化物经氯化作用生成氯化物是工业生产氯化物的常用方法,例如,工业上,常采用“加碳氯化”的方法以高钛渣(主要成分为TiO2)为原料生产TiCl4.已知:
TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) ΔH1=+175.4kJ·mol-1;KI=3.4×10-29
2C(s)+O2(g)=2CO(g) ΔH2=-220.9kJ·mol-1;KII=1.2×1048
沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:
(2)Cl2合成有机物时会产生副产物HCl。4HCl+O2
①若该反应在体积不变的密闭容器中发生,当反应达平衡时,下列叙述正确的是
a.v(HCl)=2v(Cl2)
b.4v正(HCl)=v逆(O2)
c.又加入1molO2,达新平衡时,HCl的转化率增大
d.分离出H2O,达新平衡时,v正(HCl)增大
②下图是该反应两种投料比[n(HCl):n(O2)分别为4:1和2:1]下,反应温度对HCl平衡转化率影响的曲线。下列叙述正确的是

a.该反应的正反应是放热反应
b.其他条件不变,升高温度,平衡常数K值增大
c.若平衡常数K值变大,达新平衡前v逆始终减小
d.若平衡常数K值变大,则平衡向正反应方向移动
(3)在一定温度下,氯气溶于水的过程及其平衡常数为:
Cl2(g)⇌Cl2(aq) K1=c(Cl2)/p
Cl2(aq)+H2O(l)⇌H+(aq)+Cl-(aq)+HClO(aq) K2
其中p为Cl2(g)的平衡压强,c(Cl2)为Cl2在水溶液中的平衡浓度。
①Cl2(g)⇌Cl2(aq)的焓变ΔH1
②平衡常数K2的表达式为K2=
③氯气在水中的溶解度(以物质的量浓度表示)为c,则c=
(4)在一定温度下,以I2为催化剂,氯苯和Cl2在CS2中发生平行反应,分别生成邻二氯苯和对二氯苯,两产物浓度之比与反应时间无关。反应物起始浓度均为0.5mol·L-1,反应30min测得氯苯15%转化为邻二氯苯,25%转化为对二氯苯。保持其他条件不变,若要提高产物中邻二氯苯的比例,可采用的措施是___。
| A.适当提高反应温度 | B.改变催化剂 |
| C.适当降低反应温度 | D.改变反应物浓度 |
21-22高三上·黑龙江大庆·开学考试
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网




