解答题-原理综合题 较难0.4 引用1 组卷369
将二氧化碳转化为高附加值碳基燃料可有效减少碳排放。二氧化碳催化加氢制甲醇 引起了科学界和工业界的极大兴趣。回答下列问题:
引起了科学界和工业界的极大兴趣。回答下列问题:
(1)相关的化学键键能数据如下表所示。
写出二氧化碳催化加氢制甲醇的热化学方程式:_______ 。
(2)采用真空封管法制备磷化硼纳米颗粒,成功的实现了高选择性电催化还原 制备甲醇,该反应历程如图所示。
制备甲醇,该反应历程如图所示。
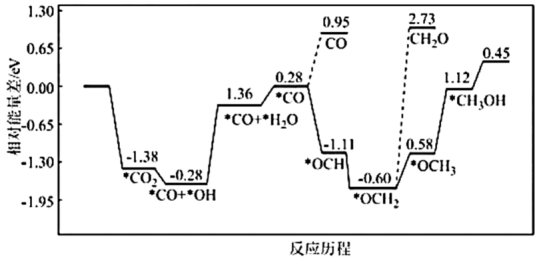
①该过程容易产生副产物_______ 。
②上述合成甲醇的反应速率较慢,要使反应速率加快,需要降低某步骤的能量变化,写出该基元反应的化学方程式:_______ 。
(3)工业中, 和
和 在催化剂作用下可发生两个平行反应,分别生成
在催化剂作用下可发生两个平行反应,分别生成 和
和 。
。
反应a:
 ;
;
反应b:
 。
。
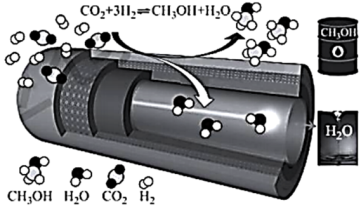
在传统的催化固定反应床( )中,
)中, 转化率和甲醇选择性通常都比较低,科学团队发展了一种具有反应分离双功能的分子筛膜催化反应器(
转化率和甲醇选择性通常都比较低,科学团队发展了一种具有反应分离双功能的分子筛膜催化反应器( )用于
)用于 催化加氢制备甲醇,极大地改善了该问题,原理如下图所示。
催化加氢制备甲醇,极大地改善了该问题,原理如下图所示。
保持压强为 ,向密闭容器中投入一定量
,向密闭容器中投入一定量 和
和 ,不同反应模式下
,不同反应模式下 的平衡转化率和甲醇选择性的相关实验数据如下表所示。
的平衡转化率和甲醇选择性的相关实验数据如下表所示。
已知 选择性:转化的
选择性:转化的 中生成
中生成 的百分比。
的百分比。
① 模式时,投料比
模式时,投料比 ,一定温度下发生反应,下列说法能作为反应
,一定温度下发生反应,下列说法能作为反应 达到平衡状态的判据是
达到平衡状态的判据是_______ (填选项字母)。
A.气体密度不再变化
B.CO的体积分数不再变化
C.气体平均相对分子质量不再变化
D. 不再变化
不再变化
E. 、
、 、
、 、
、 的物质的量之比为
的物质的量之比为
②由表中数据可知 模式下,
模式下, 的转化率显著提高,结合具体反应分析可能的原因:
的转化率显著提高,结合具体反应分析可能的原因:_______ 。
③压力平衡常数 是指用平衡分压代替平衡浓度进行计算的平衡常数,平衡分压
是指用平衡分压代替平衡浓度进行计算的平衡常数,平衡分压 总物质的量分数。根据表中数据计算温度为
总物质的量分数。根据表中数据计算温度为 时,反应a的
时,反应a的 值为
值为_______ (无需计算,写表达式)。
(1)相关的化学键键能数据如下表所示。
| 化学键 | |||||
(2)采用真空封管法制备磷化硼纳米颗粒,成功的实现了高选择性电催化还原

①该过程容易产生副产物
②上述合成甲醇的反应速率较慢,要使反应速率加快,需要降低某步骤的能量变化,写出该基元反应的化学方程式:
(3)工业中,
反应a:
反应b:
在传统的催化固定反应床(

保持压强为
| 实验组 | 反应模式 | 压强/ | 温度/℃ | |||
| ① | ||||||
| ② | ||||||
| ③ |
①
A.气体密度不再变化
B.CO的体积分数不再变化
C.气体平均相对分子质量不再变化
D.
E.
②由表中数据可知
③压力平衡常数
20-21高三·广东·阶段练习
类题推荐
我国对世界郑重承诺:2030年前实现碳达峰,2060年前实现碳中和。而研发二氧化碳的碳捕集和碳利用技术则是关键,其中催化转化法最具应用价值。回答下列问题:
Ⅰ.一定温度下, 和
和 在催化剂作用下可发生两个平行反应,分别生成
在催化剂作用下可发生两个平行反应,分别生成 和
和 。
。
a:
b:
(1)相同温度下,
_______ 。
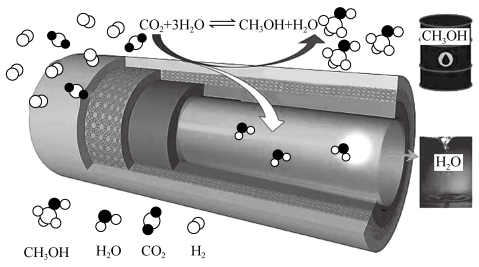
(2)在传统的催化固定反应床 中,
中, 转化率和甲醇选择性通常都比较低,科学团队研制了一种具有反应和分离双功能的分子筛膜催化反应器
转化率和甲醇选择性通常都比较低,科学团队研制了一种具有反应和分离双功能的分子筛膜催化反应器 ,极大地改善了该问题,原理如图所示。
,极大地改善了该问题,原理如图所示。
保持压强为 ,温度为
,温度为 ,向密闭容器中投料比按
,向密闭容器中投料比按 投入一定量
投入一定量 和
和 ,不同反应模式下
,不同反应模式下 的平衡转化率和甲醇选择性的相关实验数据如下表所示。
的平衡转化率和甲醇选择性的相关实验数据如下表所示。
已知 选择性:转化的
选择性:转化的 中生成
中生成 的百分比。
的百分比。
① 模式时,上述条件下发生反应,下列说法能作为反应a达到平衡状态的判据是
模式时,上述条件下发生反应,下列说法能作为反应a达到平衡状态的判据是_______ (填选项字母)。
A.气体压强不再变化 B.气体平均相对分子质量不再变化
C. 不再变化 D.
不再变化 D. 的物质的量之比为
的物质的量之比为
②由表中数据可知 模式下,
模式下, 的转化率明显提高,结合具体反应分析可能的原因:
的转化率明显提高,结合具体反应分析可能的原因:_______ 。
(3)反应b在进气比 不同时,测得相应的
不同时,测得相应的 平衡转化率见图(各点对应的反应温度可能相同,也可能不同,其他反应条件都相同)。
平衡转化率见图(各点对应的反应温度可能相同,也可能不同,其他反应条件都相同)。
①D和F两点对应的温度关系:
_______  (填<,>,或=),其原因是
(填<,>,或=),其原因是_______ 。

②已知反应速率 ,
, ,k为反应速率常数,x为物质的量分数,在达到平衡状态为G点的反应过程(此过程为恒温)中,当
,k为反应速率常数,x为物质的量分数,在达到平衡状态为G点的反应过程(此过程为恒温)中,当 的转化率刚好达到
的转化率刚好达到 时,
时,
_______ 。
Ⅱ.用下图装置电解二氧化碳也可制取甲醇,控制在一定温度左右,持续通入二氧化碳,电解过程中 物质的量基本不变。
物质的量基本不变。
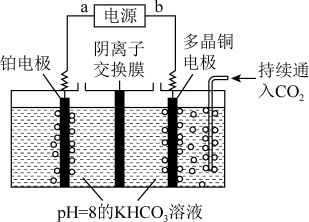
(4)阴极电极反应式为:_______ 。
Ⅰ.一定温度下,
a:
b:
(1)相同温度下,
(2)在传统的催化固定反应床

保持压强为
| 实验组 | 反应模式 | 温度/ | |||
| ① | 3 | 260 | 21.9 | 67.3 | |
| ② | 3 | 260 | 36.1 | 100.0 |
①
A.气体压强不再变化 B.气体平均相对分子质量不再变化
C.
②由表中数据可知
(3)反应b在进气比
①D和F两点对应的温度关系:

②已知反应速率
Ⅱ.用下图装置电解二氧化碳也可制取甲醇,控制在一定温度左右,持续通入二氧化碳,电解过程中

(4)阴极电极反应式为:
我国对世界郑重承诺:2030年前实现碳达峰,2060年前实现碳中和,其中的关键技术是运用催化转化法实现二氧化碳的碳捕集和碳利用。请回答下列问题:
Ⅰ、一定温度下, 和
和 在催化剂作用下可发生a、b两个平行反应,分别生成
在催化剂作用下可发生a、b两个平行反应,分别生成 和
和 。
。
a:
b:
(1)相同温度下,反应 的
的
___________  。
。
(2)在传统的催化固定反应床 中,
中, 的转化率和甲醇的选择性通常都比较低。后来,科学团队研制了一种具有反应和分离双功能的分子筛膜催化反应器
的转化率和甲醇的选择性通常都比较低。后来,科学团队研制了一种具有反应和分离双功能的分子筛膜催化反应器 ,极大地改善了该问题,其原理如图1所示:
,极大地改善了该问题,其原理如图1所示:

保持压强为 ,温度为
,温度为 ,向密闭容器中按投料比,
,向密闭容器中按投料比, 投入一定量
投入一定量 和
和 ,不同反应模式下
,不同反应模式下 的平衡化率和
的平衡化率和 的选择性的相关实验数据如下表所示。
的选择性的相关实验数据如下表所示。
已知: 的选择性是指转化的
的选择性是指转化的 中生成
中生成 的百分比。
的百分比。
①在 模式下,按上述条件发生反应。下列说法能证明反应a达到平衡状态的是
模式下,按上述条件发生反应。下列说法能证明反应a达到平衡状态的是___________ (填字母)。
A.气体压强不再变化
B.气体的平均相对分子质量不再变化
C. 不再变化
不再变化
D. 的物质的量之比为
的物质的量之比为
②由表中数据可知,在 模式下,
模式下, 的转化率明显提高,结合具体反应分析可能的原因是
的转化率明显提高,结合具体反应分析可能的原因是___________ 。
(3)反应b在进气比 不同时,测得
不同时,测得 的平衡转化率如图2所示(各点对应的反应温度可能相同,也可能不同,其他反应条件均相同)。
的平衡转化率如图2所示(各点对应的反应温度可能相同,也可能不同,其他反应条件均相同)。
①D和F两点对应的温度关系:
___________  (填“>”、“=”或“<”),其原因是
(填“>”、“=”或“<”),其原因是___________ 。

②恒温条件下,在达到平衡状态为G点的反应过程中,当 的转化率刚好达到
的转化率刚好达到 时,
时,
___________  (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
Ⅱ、用图3所示装置电解二氧化碳也可制取甲醇,控制在一定温度范围内,持续通入二氧化碳,电解过程中 的物质的量基本不变。
的物质的量基本不变。
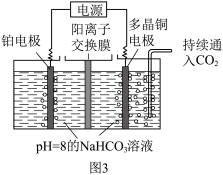
(4)阴极的电极反应式为___________ 。
Ⅰ、一定温度下,
a:
b:
(1)相同温度下,反应
(2)在传统的催化固定反应床

保持压强为
| 实验组 | 反应模式 | 温度/ | |||
| ① | 3 | 260 | 21.9 | 67.3 | |
| ② | 3 | 260 | 36.1 | 100.0 |
①在
A.气体压强不再变化
B.气体的平均相对分子质量不再变化
C.
D.
②由表中数据可知,在
(3)反应b在进气比
①D和F两点对应的温度关系:

②恒温条件下,在达到平衡状态为G点的反应过程中,当
Ⅱ、用图3所示装置电解二氧化碳也可制取甲醇,控制在一定温度范围内,持续通入二氧化碳,电解过程中

(4)阴极的电极反应式为
研发二氧化碳的碳捕集和碳利用技术是科学研究热点问题,其中催化转化法最具应用价值。回答下列问题:
(1)常温常压下,一些常见物质的燃烧热如表所示:
已知:

则

__________  ,该反应在
,该反应在__________ (填“高温”、“低温”或“任意温度”)下能自发。
(2)在氢气还原 的催化反应中,
的催化反应中, 可被催化转化为甲醇,同时有副产物CO生成,为了提高甲醇的选择性,某科研团队研制了一种具有反应和分离双功能的分子筛膜催化反应器,原理如图所示。
可被催化转化为甲醇,同时有副产物CO生成,为了提高甲醇的选择性,某科研团队研制了一种具有反应和分离双功能的分子筛膜催化反应器,原理如图所示。
保持压强为3MPa,温度为260℃,向密闭容器中按投料比 投入一定量
投入一定量 和
和 ,不同反应模式下
,不同反应模式下 的平衡转化率和甲醇的选择性的相关实验数据如下表所示。
的平衡转化率和甲醇的选择性的相关实验数据如下表所示。
①分子筛膜催化反应器(恒温恒容)模式中,发生反应 ,下列说法能作为此反应达到平衡状态的判据的是
,下列说法能作为此反应达到平衡状态的判据的是__________ (填标号)。
A.气体压强不再变化 B.气体的密度不再改变
C. D.
D.
②由表中数据可知双功能的分子筛膜催化反应器模式下, 的转化率明显提高,结合具体反应分析可能的原因:
的转化率明显提高,结合具体反应分析可能的原因:__________ 。
(3)二氧化碳催化加氢制甲醇的反应中 在起始物
在起始物 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在
,在 ℃时,
℃时, 随压强(p)的变化及在
随压强(p)的变化及在 时
时 随温度(T)的变化,如图所示。
随温度(T)的变化,如图所示。
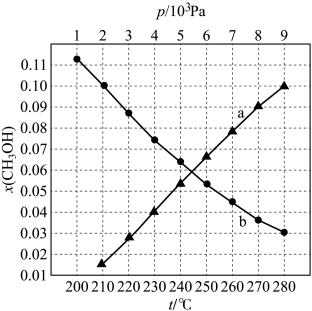
①图中对应等压过程的曲线是______ (填“a”或“b”),判断的理由是__________ 。
②恒温时( ℃),当
℃),当 时,
时, 的平衡转化率
的平衡转化率
__________ (保留小数点后一位),此条件下该反应的
__________  。(保留小数点后两位)(对于气相反应,可以用分压表示,分压=总压×物质的量分数)。
。(保留小数点后两位)(对于气相反应,可以用分压表示,分压=总压×物质的量分数)。
(1)常温常压下,一些常见物质的燃烧热如表所示:
名称 | 氢气 | 甲烷 | 一氧化碳 | 甲醇 |
化学式 | ||||
则
(2)在氢气还原

保持压强为3MPa,温度为260℃,向密闭容器中按投料比
实验组 | 反应模式 | 温度/℃ |
|
| |
① | 普通催化反应器 | 3 | 260 | 21.9 | 67.3 |
② | 分子筛膜催化反应器 | 3 | 260 | 36.1 | 100 |
A.气体压强不再变化 B.气体的密度不再改变
C.
②由表中数据可知双功能的分子筛膜催化反应器模式下,
(3)二氧化碳催化加氢制甲醇的反应中

①图中对应等压过程的曲线是
②恒温时(
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


