解答题-实验探究题 适中0.65 引用4 组卷554
高铁酸钾(K2FeO4)是一种强氧化剂和环境友好型水处理剂,易分解,遇水和酸易变质。学习小组在实验室对高铁酸钾的制备和一些性质进行探究。
回答下列问题:
(1)高铁酸钾的制备。
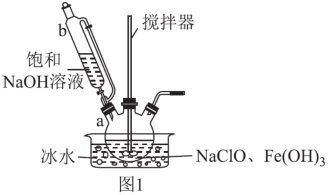
步骤一:制备Na2FeO4,装置如图1所示。将b中饱和NaOH溶液全部逐滴滴入a中,充分反应;
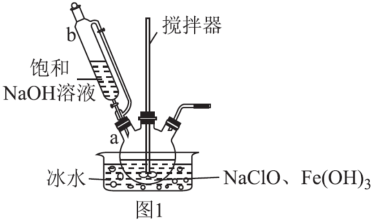
步骤二:由b向a中反应后液体中加入饱和KOH溶液;
步骤三:将a中所得浊液移出,分离提纯。
①仪器b的名称为___ ,其侧管的作用为___ 。
②步骤一中采用冰水浴冷却的目的为___ ;a中制备Na2FeO4反应的离子方程式为___ 。
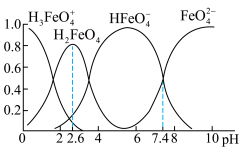
③步骤二中,能得到K2FeO4悬浊液的原因为___ 。
④K2FeO4悬浊液经过滤、洗涤、提纯,可得产品。其中提纯所用的操作名称为___ 。
(2)K2FeO4遇水转化为Fe(OH)3,则其作水处理剂的优点为___ 。
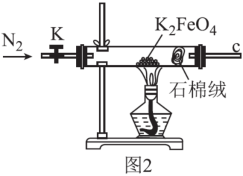
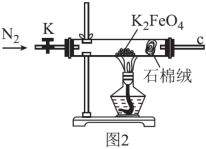
(3)用图2所示装置检验K2FeO4受热分解的产物。
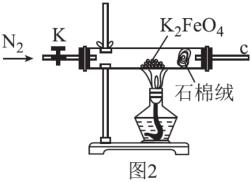
①检验分解的气体产物为O2的操作和现象为___ 。
②设计实验证明完全分解后的固体产物中不含Fe(Ⅱ)___ 。
回答下列问题:
(1)高铁酸钾的制备。
步骤一:制备Na2FeO4,装置如图1所示。将b中饱和NaOH溶液全部逐滴滴入a中,充分反应;

步骤二:由b向a中反应后液体中加入饱和KOH溶液;
步骤三:将a中所得浊液移出,分离提纯。
①仪器b的名称为
②步骤一中采用冰水浴冷却的目的为
③步骤二中,能得到K2FeO4悬浊液的原因为
④K2FeO4悬浊液经过滤、洗涤、提纯,可得产品。其中提纯所用的操作名称为
(2)K2FeO4遇水转化为Fe(OH)3,则其作水处理剂的优点为
(3)用图2所示装置检验K2FeO4受热分解的产物。

①检验分解的气体产物为O2的操作和现象为
②设计实验证明完全分解后的固体产物中不含Fe(Ⅱ)
20-21高三·河南·开学考试
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网