填空题 较难0.4 引用1 组卷182
电解质溶液A:25g CuSO4·5H2O + 4mL浓H2SO4 + 200mL H2O
电解质溶液B:16g CuCl+ 100mL浓HCIl+ 100mL H2O + 4g铜粉
以铜为电极,通电电解串连的两个电解槽(分别盛电解质溶液A和电解质溶液B)。正极质量改变如下表所示:
(1)正极质量改变不同的原因_______ 。
(2)电解质液中加铜粉的原因是_______ 。
(3)从理论上讲,电解过程铜粉质量不会改变,为什么?实际情况如何_______ 。
电解质溶液B:16g CuCl+ 100mL浓HCIl+ 100mL H2O + 4g铜粉
以铜为电极,通电电解串连的两个电解槽(分别盛电解质溶液A和电解质溶液B)。正极质量改变如下表所示:
| 电解前质量/g | 电解后质量/g | 改变量/g | ||
| 电解质液A | 正极 | 7.4 | 7.3 | -0.1 |
| 负极 | 7.5 | 7.6 | 0.1 | |
| 电解质液B | 正极 | 7.4 | 7.2 | -0.2 |
| 负极 | 7.3 | 7.5 | 0.2 |
(1)正极质量改变不同的原因
(2)电解质液中加铜粉的原因是
(3)从理论上讲,电解过程铜粉质量不会改变,为什么?实际情况如何
2007高一·北京·竞赛
类题推荐
碳及其化合物应用广泛。
I.工业上利用CO和水蒸气反应制氢气,存在以下平衡:
CO(g)+H2O(g) CO2(g)+H2(g)△H>0
CO2(g)+H2(g)△H>0
(1)向1L恒容密闭容器中注入CO(g)和H2O(g),830℃时测得部分数据如下表。则该温度下反应的平衡常数K=______________ 。
(2)相同条件下,向1L恒容密闭容器中,同时注入2mol CO、2mol H2O(g),1molCO2和1molH2,此时v(正 ) __________ v(逆)(填“>”“=”或“<”)
(3)上述反应达到平衡时,要提高CO的转化率,可采取的措施是_______ (填字母代号)。
A.升高温度
B.加入催化剂
C.增大压强
D.增加CO的浓度
E.及时分离出CO2
II.已知CO(g)+1/2 O2(g)=CO2(g) △H=-141 kJ·mol-1
2H2(g)+ O2(g)=2H2O(g) △H=-484 kJ·mol-1
CH3OH(1)+3/2O2(g)=CO2(g)+2H2O(g) △H=-726 kJ·mol-1
(4)用CO(g)、H2(g)化合制得液态甲醇的热化学方程式为___________________________ 。
III.某同学设计了一个甲醇燃料电池,并用该电池电解100mL一定浓度NaCl与CuSO4混合溶液,其装置如图:
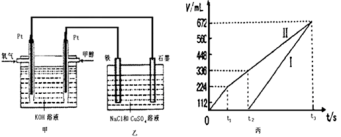
(5)写出甲中通入甲醇这一极的电极反应式__________________________________ 。
(6)理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式____________ ,原混合溶液中CuSO4的物质的量浓度____________ mol/L。(假设溶液体积不变)
(7)将在t2时所得的溶液稀释至200mL,该溶液的pH约为___________ 。
I.工业上利用CO和水蒸气反应制氢气,存在以下平衡:
CO(g)+H2O(g)
(1)向1L恒容密闭容器中注入CO(g)和H2O(g),830℃时测得部分数据如下表。则该温度下反应的平衡常数K=
| t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| n( CO)/mol | 0.200 | 0.160 | 0.125 | 0.099 | 0.080 | 0.080 |
| n( H2O)/mol | 0.300 | 0.260 | 0.225 | 0.199 | 0.180 | 0.180 |
(3)上述反应达到平衡时,要提高CO的转化率,可采取的措施是
A.升高温度
B.加入催化剂
C.增大压强
D.增加CO的浓度
E.及时分离出CO2
II.已知CO(g)+1/2 O2(g)=CO2(g) △H=-141 kJ·mol-1
2H2(g)+ O2(g)=2H2O(g) △H=-484 kJ·mol-1
CH3OH(1)+3/2O2(g)=CO2(g)+2H2O(g) △H=-726 kJ·mol-1
(4)用CO(g)、H2(g)化合制得液态甲醇的热化学方程式为
III.某同学设计了一个甲醇燃料电池,并用该电池电解100mL一定浓度NaCl与CuSO4混合溶液,其装置如图:

(5)写出甲中通入甲醇这一极的电极反应式
(6)理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式
(7)将在t2时所得的溶液稀释至200mL,该溶液的pH约为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网






