解答题-无机推断题 适中0.65 引用1 组卷67
元素A、B、C、D、E的原子序数逐渐增大。A原子核外电子只有一种运动状态;B原子第二能层电子数等于该能层轨道数,B、C、D核电荷数依次增加1;E基态原子核外第四能级组有11个电子分布于两个能级轨道之中,其中一个能级全充满,一个半充满。
(1)A、B、C、D原子半径由小到大的顺序为(写元素符号)_______ 与E同副族的第六周元素符号是_______ ,其基态原子的电子排布式:_______ 。
(2)由元素A、B、C、D构成微粒结构简式如下,请分别画出它们的Lewis结构式并命名。(要求:画出所有未共享电子对)。
①ADBC:_______
②ABCD:_______
③ADCB:_______
④CD :
:_______
(3)指出下列配合物(或配离子)中心体的配位数和价态:
①[PtCl3(C2H4)]-:_______
②trans-[Co(en)2C12]+:_______ [en:H2NCH2CH2NH2]。
(4)回答下列问题:
①在通常状况下,He、Ne、Ar、Kr、Xe在水中溶解度[mol/1kgH2O]递增,其原因是_______ 。
②在水溶液中,邻-羟基苯甲酸的酸性(Ka1=105×10-5)大于间-羟基苯甲酸的酸性(Ka1=8.3×10-5),其原因是_______ 。
③在一定条件下,强路易斯酸AsF5能诱导溴元素发生归中反应:4Br2+BrF3+3AsF5=3Br AsFf
AsFf ,产物阳离子空间构型为
,产物阳离子空间构型为_______ ,产物阴离子中心原子的轨道采用_______ 杂化。
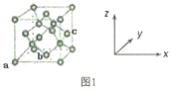
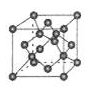
(5)B的常见单质的两种结构如下图所示,左、右分别为立方和六方的骨架结构。
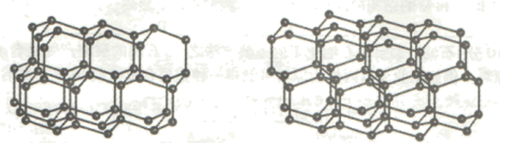
该单质的名称为_______ ;两种骨架结构中每个B原子都以“B-B”键与另外四个B原子相连,每个B原子参与形成_______ 个六元环;两种骨架结构不相同之处是六元环的构型,请说明有何不同:_______ 。
(1)A、B、C、D原子半径由小到大的顺序为(写元素符号)
(2)由元素A、B、C、D构成微粒结构简式如下,请分别画出它们的Lewis结构式并命名。(要求:画出所有未共享电子对)。
①ADBC:
②ABCD:
③ADCB:
④CD
(3)指出下列配合物(或配离子)中心体的配位数和价态:
①[PtCl3(C2H4)]-:
②trans-[Co(en)2C12]+:
(4)回答下列问题:
①在通常状况下,He、Ne、Ar、Kr、Xe在水中溶解度[mol/1kgH2O]递增,其原因是
②在水溶液中,邻-羟基苯甲酸的酸性(Ka1=105×10-5)大于间-羟基苯甲酸的酸性(Ka1=8.3×10-5),其原因是
③在一定条件下,强路易斯酸AsF5能诱导溴元素发生归中反应:4Br2+BrF3+3AsF5=3Br
(5)B的常见单质的两种结构如下图所示,左、右分别为立方和六方的骨架结构。

该单质的名称为
2014高二·河南·竞赛
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网