解答题-原理综合题 较难0.4 引用1 组卷60
化石燃料的燃烧会产生大量污染大气的二氧化硫和温室气体二氧化碳。而氢气和氨气都被认为是无碳无污染的清洁能源。
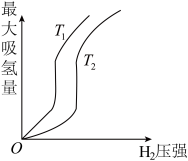
(1)某些合金可用于储存氢,金属储氢的原理可表示为:M+xH2⇌MH2x △H<0 (M 表示某种合金)。如图表示温度分别为T1、T2时,最大吸氢量与氢气压强的关系。则下列说法中,正确的是_______。
(2)以熔融碳酸盐为电解质,稀土金属材料为电极组成氢氧燃料电池(如下图装置甲所示),其中负极通入H2,正极通入O2和CO2的混合气体。乙装置中a、b为石墨,电解一段时间后,b电极附近滴入酚酞溶液变红,NaCl溶液的体积为100mL。
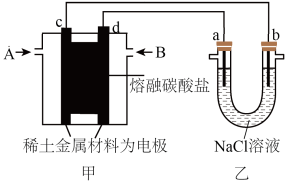
①工作过程中,甲装置中d电极的电极反应式为_______ ,乙装置中电极a为_______ 极(填电极名称)。
②若在a极产生112mL(标准状况)气体,25°C时乙装置中所得溶液pH=_______ 。(忽略电解前后溶液体积变化)
(3)氨在氧气中燃烧,生成水和一种空气组成成分的单质。
已知:N2(g)+3H2(g)⇌2NH3(g) △H=-92.4kJ·mol-1
2H2(g) +O2(g) =2H2O(l) △H= -572 kJ·mol-1
试写出氨在氧气中燃烧生成液态水的热化学方程式:_______ 。
(4)在一定条件下,将1molN2和3molH2混合于一个10L的容积不变的密闭容器中发生反应:N2+3H2 2NH3△H<0,已知5分钟后达到平衡,平衡时氨的体积分数为25%。
2NH3△H<0,已知5分钟后达到平衡,平衡时氨的体积分数为25%。
①该反应的平衡常数表达式为_______ ;
②反应开始到平衡时N2的消耗速率v(N2)=_______ ;
③能判断该反应是否达到化学平衡状态的依据是_______ ;
a.容器中压强不变
b.混合气体的密度不变
c.3v正(H2)=2v逆(NH3)
d.c(N2)∶c(H2)∶c(NH3)=1∶3∶2
④对于上述平衡状态,改变下列条件能使反应速率增大,且能使平衡向正反应方向移动的是_______ 。
a.选用更高效的催化剂
b.升高温度
c.及时分离出氨气
d.增加H2的依度
e.充入He,使体系总压强增大
(1)某些合金可用于储存氢,金属储氢的原理可表示为:M+xH2⇌MH2x △H<0 (M 表示某种合金)。如图表示温度分别为T1、T2时,最大吸氢量与氢气压强的关系。则下列说法中,正确的是_______。

| A.T1>T2 |
| B.增大氢气压强,加快氢气的吸收速率 |
| C.增大M的量,上述平衡向右移动 |
| D.上述反应可实现多次储存和释放氢气 |

①工作过程中,甲装置中d电极的电极反应式为
②若在a极产生112mL(标准状况)气体,25°C时乙装置中所得溶液pH=
(3)氨在氧气中燃烧,生成水和一种空气组成成分的单质。
已知:N2(g)+3H2(g)⇌2NH3(g) △H=-92.4kJ·mol-1
2H2(g) +O2(g) =2H2O(l) △H= -572 kJ·mol-1
试写出氨在氧气中燃烧生成液态水的热化学方程式:
(4)在一定条件下,将1molN2和3molH2混合于一个10L的容积不变的密闭容器中发生反应:N2+3H2
①该反应的平衡常数表达式为
②反应开始到平衡时N2的消耗速率v(N2)=
③能判断该反应是否达到化学平衡状态的依据是
a.容器中压强不变
b.混合气体的密度不变
c.3v正(H2)=2v逆(NH3)
d.c(N2)∶c(H2)∶c(NH3)=1∶3∶2
④对于上述平衡状态,改变下列条件能使反应速率增大,且能使平衡向正反应方向移动的是
a.选用更高效的催化剂
b.升高温度
c.及时分离出氨气
d.增加H2的依度
e.充入He,使体系总压强增大
2014高二·河南·竞赛
类题推荐
氢气和氨气都属于无碳清洁能源。
(1)某些合金可用于储存氢,金属储氢的原理可表示为:M(s)+xH2 MH2x(s) △H<0(M表示某种合金)
MH2x(s) △H<0(M表示某种合金)
下图表示温度分别为T1、T2时,最大吸氢量与氢气压强的关系。则下列说法中,正确的是______

(2)以熔融碳酸盐为电解质,稀土金属材料为电极组成氢氧燃料电池(如装置甲所示),其中负极通入H2,正极通入O2和CO2的混合气体。乙装置中a、b为石墨电极,电解过程中,b极质量增加。

①工作过程中,甲装置中d电极上的电极反应式为____________________ 。
②若用该装置电解精炼铜,则b极接____ (填“粗铜”或“精铜”);若用该装置给铁制品上镀铜,则____ (填“a”或“b”)极可用惰性电极(如Pt电极),若电镀量较大,需要经常补充或更换的是_______ 。
(3)氨在氧气中燃烧,生成水和一种空气组成成分的单质。
已知:①N2(g)十3H2(g) 2NH3(g) △H=
2NH3(g) △H= 92.4kJ·mol-1
92.4kJ·mol-1
②2H2(g)十O2(g)=2H2O(1)△H=-572KJ·mol-1
试写出氨气在氧气中燃烧生成液态水的热化学方程式___________________ 。
(4)在一定条件下,将lmolN2和3molH2混台于一个10L的密闭容器中发生反应:
N2(g)+3H2(g) 2NH3(g)
2NH3(g)
5min后达到平衡,平衡时氮气的转化率为a。
①该反应的平衡常数K=________ ,(用含a的代数式表示)
②从反应开始到平衡时N2的消耗速率v(N2)=____ mol·L-1·min-1。(用含a的代数式表示)
(1)某些合金可用于储存氢,金属储氢的原理可表示为:M(s)+xH2
 MH2x(s) △H<0(M表示某种合金)
MH2x(s) △H<0(M表示某种合金)下图表示温度分别为T1、T2时,最大吸氢量与氢气压强的关系。则下列说法中,正确的是

| A.T1>T2 |
| B.增大氢气压强,加快氢气的吸收速率 |
| C.增大M的量,上述平衡向右移动 |
| D.在恒温、恒容容器中,达平衡后充入H2,再次平衡后的压强增大 |

①工作过程中,甲装置中d电极上的电极反应式为
②若用该装置电解精炼铜,则b极接
(3)氨在氧气中燃烧,生成水和一种空气组成成分的单质。
已知:①N2(g)十3H2(g)
 2NH3(g) △H=
2NH3(g) △H=②2H2(g)十O2(g)=2H2O(1)△H=-572KJ·mol-1
试写出氨气在氧气中燃烧生成液态水的热化学方程式
(4)在一定条件下,将lmolN2和3molH2混台于一个10L的密闭容器中发生反应:
N2(g)+3H2(g)
 2NH3(g)
2NH3(g)5min后达到平衡,平衡时氮气的转化率为a。
①该反应的平衡常数K=
②从反应开始到平衡时N2的消耗速率v(N2)=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网






