单选题 较难0.4 引用1 组卷407
常温下,向20ml0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液,有关微粒的物质的量的变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)所示,判断下列说法正确的是
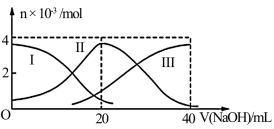

| A.H2A在水中的电离方程式是H2A=H++HA-;HA-⇌H++A2- |
| B.当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HAˉ)>c(H+)>c(A2-)>c(OHˉ) |
| C.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水的大,NaHA溶液中:c(OH-)+c(A2-)=c(H+)+c(H2A) |
| D.当V(NaOH)=30mL时,溶液中存在以下关系:2c(H+)+c(HAˉ)+2c(H2A)=c(A2-)+2c(OHˉ) |
18-19高二上·新疆乌鲁木齐·期末
类题推荐
常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。根据图示判断,下列说法正确的是
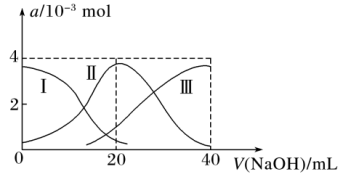

| A.当V(NaOH溶液)=40 mL时,其溶液中水的电离程度比纯水小 |
| B.NaHA溶液中:c(OH-)+c(A2-)=c(H+)+c(H2A) |
| C.当V(NaOH溶液)=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(A2-)>c(HA-)>c(H+)>c(OH-) |
| D.向Na2A溶液加入水的过程中,pH可能增大也可能减小 |
常温下,向 20 mL 0.2 mol/LH2A溶液中滴加0. 2 mol/L NaOH溶液.有关微粒的物质的量变化曲线如图所示(其中I代表H2A.,II代表HA—,III表A2—)。根据图示.判断下列说法正确的是
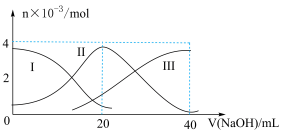

| A.当V(NaOH)=20 mL时.溶液中各离子浓度的大小关系为c(Na+)>c(HA—)>c(H+)>c(A2一)>c(OH—) |
| B.等体积、等物质的量浓度的NaOH溶液与H2 A溶液混合后,其溶液中水的电离程度比纯水中的大 |
| C.NaHA溶液中:c(OH—)+2c(A2—) =c(H+) +c(H2A ) |
| D.将Na2A溶液加水稀释.溶液中所有离子的浓度都减小.但部分离子的物质的量增加 |
常温下,向20mL0.2 mol·L-1H2A溶液中滴加0.2 mol·L-1NaOH溶液。有关微粒的物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是


| A.当V( NaOH )= 20mL时,pH<7 |
| B.当V(NaOH)= 20mL时,溶液中离子浓度大小关系为c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+) |
| C.当V(NaOH)= 10mL时,有c(Na+)=2[c(HA-)+c(A2-)+c(H2A)] |
| D.当V(NaOH)= 30mL时,2c(H+)+3c(H2A)+c(HA-)= 2c(OH-)+c(A2-) |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


