解答题-实验探究题 适中0.65 引用1 组卷51
硫酸铜受热分解生成氧化铜和气体,受热温度不同生成的气体成分也不同。气体成分可能含SO2、SO3和O2中的一种、二种或三种。某化学课外活动小组通过设计以下探究性实验,探究测定反应产生的SO2、SO3和O2的物质的量,并经计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式。实验用到的仪器如下图所示:
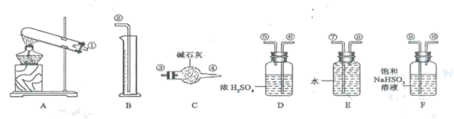
(1)[提出猜想]
①所得气体的成分可能只含_______ 一种。
②所得气体的成分可能含有_______ 二种。
③所得气体的成分可能含有_______ 三种。
(2)[实验探究]
实验操作过程(略),已知实验结束时,硫酸铜完全分解。请回答下列问题:
①请你组装探究实验的装置,按从左至右的方向,各仪器接口连接顺序为_______ (填序号)。
②若实验结束,B中量筒没有收集到水,则证明猜想_______ 。正确。
③若实验结束,经测定装置C的总质量增加了,能否肯定气体产物中含有SO2而不含SO3。请说明理由_______ 。
④有两个实验小组进行该实验,由于加热时的温度不同,实验结束后测得相关数据也不同,数据如下:
请通过计算,推断出第一小组和第二小组的实验条件下CuSO4分解的化学反应方程式:
一组:_______ ;二组:_______ 。

(1)[提出猜想]
①所得气体的成分可能只含
②所得气体的成分可能含有
③所得气体的成分可能含有
(2)[实验探究]
实验操作过程(略),已知实验结束时,硫酸铜完全分解。请回答下列问题:
①请你组装探究实验的装置,按从左至右的方向,各仪器接口连接顺序为
②若实验结束,B中量筒没有收集到水,则证明猜想
③若实验结束,经测定装置C的总质量增加了,能否肯定气体产物中含有SO2而不含SO3。请说明理由
④有两个实验小组进行该实验,由于加热时的温度不同,实验结束后测得相关数据也不同,数据如下:
| 实验小组 | 称取CuSO4的质量/g | 装置C增加的质量/g | 量筒中水的体积(折算成标准状况下气体的体积)/mL |
| 一 | 6.4 | 2.56 | 448 |
| 二 | 6.4 | 3.84 | 224 |
一组:
2011高二·河北·竞赛
类题推荐
已知CaSO4受热分解,由于受热温度不同,气体成分也不同。气体成分可能为SO2、SO3和O2中的一种、二种或三种。某化学课外活动小组准备通过系列实验探究CaSO4分解生成的气体,进而确定CaSO4分解的化学方程式。
【提出猜想】
Ⅰ.所得气体的成分可能只含 SO3一种;
Ⅱ.所得气体的成分可能含有______________ 二种;(填分子式)
Ⅲ.所得气体的成分可能含有 SO2、SO3、O2三种。
【设计实验】
该化学课外活动小组准备通过测定D装置的增重以及量筒中水的体积,来探究CaSO4分解生成的气体成分,进而确定CaSO4分解的化学方程式。
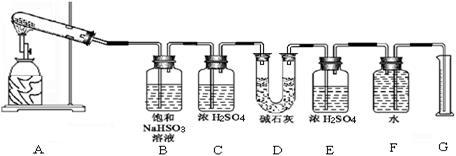
【实验过程】
根据上述实验方案进行试验。已知实验结束时,CaSO4完全分解。
请结合以下实验现象和记录的实验数据进行分析:
(1)若实验结束时,G中量筒没有收集到水,则证明猜想______ 正确。(填Ⅰ或Ⅱ或Ⅲ)
(2)若实验结束时,装置D的总质量增加,能否断定气体产物中一定含有SO2而不含SO3?请说明理由:___________________________________________________ 。
(3)该实验设计中,容易给测定带来较大误差的因素有________________________ 。
(写出一种即可)
(4)经改进后,有两组同学进行该实验,由于加热时的温度不同,实验测得数据也不同,
相关数据如下:
请通过计算,推断第二组同学得出的CaSO4分解的化学反应方程式:
第二组:______________________________________________ 。
【提出猜想】
Ⅰ.所得气体的成分可能只含 SO3一种;
Ⅱ.所得气体的成分可能含有
Ⅲ.所得气体的成分可能含有 SO2、SO3、O2三种。
【设计实验】
该化学课外活动小组准备通过测定D装置的增重以及量筒中水的体积,来探究CaSO4分解生成的气体成分,进而确定CaSO4分解的化学方程式。

【实验过程】
根据上述实验方案进行试验。已知实验结束时,CaSO4完全分解。
请结合以下实验现象和记录的实验数据进行分析:
(1)若实验结束时,G中量筒没有收集到水,则证明猜想
(2)若实验结束时,装置D的总质量增加,能否断定气体产物中一定含有SO2而不含SO3?请说明理由:
(3)该实验设计中,容易给测定带来较大误差的因素有
(写出一种即可)
(4)经改进后,有两组同学进行该实验,由于加热时的温度不同,实验测得数据也不同,
相关数据如下:
| 实验小组 | 称取CaSO4 的质量(g) | 装置D增加 的质量(g) | 量取气体体积的装置测量的气体体积 (折算成标准状况下气体的体积) (mL) |
| 一 | 4.08 | 2.56 | 224 |
| 二 | 5.44 | 2.56 | 448 |
第二组:
亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,但使用过量会使人中毒。某学习小组针对亚硝酸钠设计了如下实验:
【实验Ⅰ】制取NaNO2
该小组先查阅资料知:①2NO+Na2O2 →2NaNO2;2NO2+Na2O2 →2NaNO3;②NO能被酸性高锰酸钾氧化为NO3-,然后设计制取装置如下图(夹持装置略去):
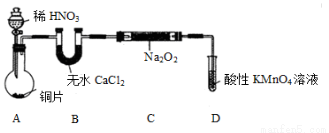
(1)装置A中用于盛放稀HNO3溶液的仪器名称为________ ;写出装置A中发生主要反应的离子方程式:__________ 。
(2)装置D的作用是____________ ;
(3)如果没有B装置,C中发生的副反应的化学方程式①_______ 、②______ 。
(4)甲同学检查完装置气密性良好后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质。下列哪种方案可以提高NaNO2纯度________ 。
A.将B中的药品换为碱石灰 B.将稀硝酸换为浓硝酸
C.实验开始前通一段时间CO2 D.在A、B之间增加盛有水的洗气瓶
【实验Ⅱ】测定NaNO2样品中NaNO3的含量
步骤:(1)配置KMnO4标准溶液并酸化,酸化KMnO4的酸应选择________ (填化学式)
(2)已知在酸性溶液中,NO2-可将MnO4-还原为Mn2+。为测定亚硝酸钠的含量,称取4.000 g样品溶于水配成250 mL溶液,取25.00 mL溶液于锥形瓶中,用0.1000 mol·L-1酸性KMnO4溶液进行滴定,消耗KMnO4 20.00mL,酸性KMnO4的作用是______ 和_______ ,计算所得固体中亚硝酸钠的质量分数__________ 。(结果保留一位小数)
【扩展实验Ⅲ】该学习小组为再了解氧族元素的一些典型化合物的性质,进行了如下实验探究。
经查知:硫酸铜受热分解生成氧化铜和气体,受热温度不同,该气体成分也不同。气体成分 可能是SO2、SO3和O2中的一种、两种或三种。他们通过设计一探究性实验,测定反应产生的SO2、SO3和O2的物质的量,并经计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式。实验用到的仪器如图所示:
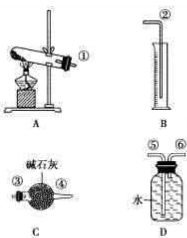
(1)提出猜想
①所得气体的成分可能只含________ 一种;
②所得气体的成分可能含有________ 两种;
③所得气体的成分可能含有SO2、SO3和O2三种。
(2)实验探究
实验操作过程(略)。已知实验结束时,硫酸铜完全分解。
请回答下列问题:
①请你组装探究实验的装置,按从左至右的方向,则仪器接口的连接顺序为______ (填序号)。
②由于加热时的温度不同,实验结束后测得相关数据也不同。数据如下:
请通过计算,推断出第一组和第二组的实验条件下CuSO4分解反应的化学方程式:
第一组_________________ ; 第二组_________________ 。
【实验Ⅰ】制取NaNO2
该小组先查阅资料知:①2NO+Na2O2 →2NaNO2;2NO2+Na2O2 →2NaNO3;②NO能被酸性高锰酸钾氧化为NO3-,然后设计制取装置如下图(夹持装置略去):

(1)装置A中用于盛放稀HNO3溶液的仪器名称为
(2)装置D的作用是
(3)如果没有B装置,C中发生的副反应的化学方程式①
(4)甲同学检查完装置气密性良好后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质。下列哪种方案可以提高NaNO2纯度
A.将B中的药品换为碱石灰 B.将稀硝酸换为浓硝酸
C.实验开始前通一段时间CO2 D.在A、B之间增加盛有水的洗气瓶
【实验Ⅱ】测定NaNO2样品中NaNO3的含量
步骤:(1)配置KMnO4标准溶液并酸化,酸化KMnO4的酸应选择
(2)已知在酸性溶液中,NO2-可将MnO4-还原为Mn2+。为测定亚硝酸钠的含量,称取4.000 g样品溶于水配成250 mL溶液,取25.00 mL溶液于锥形瓶中,用0.1000 mol·L-1酸性KMnO4溶液进行滴定,消耗KMnO4 20.00mL,酸性KMnO4的作用是
【扩展实验Ⅲ】该学习小组为再了解氧族元素的一些典型化合物的性质,进行了如下实验探究。
经查知:硫酸铜受热分解生成氧化铜和气体,受热温度不同,该气体成分也不同。气体成分 可能是SO2、SO3和O2中的一种、两种或三种。他们通过设计一探究性实验,测定反应产生的SO2、SO3和O2的物质的量,并经计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式。实验用到的仪器如图所示:

(1)提出猜想
①所得气体的成分可能只含
②所得气体的成分可能含有
③所得气体的成分可能含有SO2、SO3和O2三种。
(2)实验探究
实验操作过程(略)。已知实验结束时,硫酸铜完全分解。
请回答下列问题:
①请你组装探究实验的装置,按从左至右的方向,则仪器接口的连接顺序为
②由于加热时的温度不同,实验结束后测得相关数据也不同。数据如下:
| 实验 | 称取CuSO4的质量/g | 仪器C 增加的质量/g | 量筒中水的体积折算成标准状况下气体的体积/mL |
| 第一组 | 6.4 | 2.88 | 224 |
| 第二组 | 6.4 | 2.56 | 448 |
第一组
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网



