解答题-原理综合题 困难0.15 引用1 组卷871
反应2NO(g)+O2(g) 2NO2(g)是制取硝酸、烟气脱硝中的重要反应。回答下列问题:
2NO2(g)是制取硝酸、烟气脱硝中的重要反应。回答下列问题:
(1)NO被氧化的机理如下:第一步:NO+O2 NO3,第二步:NO3+NO
NO3,第二步:NO3+NO 2NO2,其能量与反应过程的关系如图所示:
2NO2,其能量与反应过程的关系如图所示:
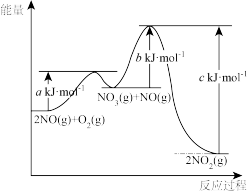
①2NO(g)+O2(g) = 2NO2(g)的ΔH___________ 0(填“>”或“<”)。图中第一步反应的逆反应的活化能为___________ kJ/mol(用含a、b、c、ΔH的代数式表示)。
②k1、k−1、k2为反应速率常数,若某反应包含多个基元反应(一步直接转化为产物的反应,如上述反应第一步与第二步均为基元反应),反应速率由最慢的一步基元反应决定,对于基元反应aA + bB=cC+dD,其速率方程为v(正)=kca(A)·cb(B)。上述第一步反应的平衡常数为___________ (用含如k1、k−1的代数式表示);写出反应2NO(g) +O2(g) 2NO2(g)的平衡速率方程:v(正)=
2NO2(g)的平衡速率方程:v(正)=___________ (用含k1、k−1、k2、c( NO)及c(O2)的代数式表示)。
(2)在恒压反应器中充入NO、O2,当O2分别过量6%、20%和100%时,NO的平衡转化率α分别如图所示(图中虚线)。
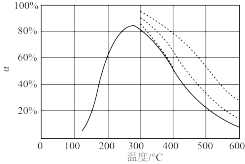
①该压强下,400℃、O2过量100%时,NO的平衡转化率α =___________
②图中实线为相同时间内NO的转化率随温度的变化曲线,实线左侧,随温度升高,NO的转化率逐渐增大,其原因是___________ 。
(3)若在恒压反应器中充入m mol NO和n mol O2,在温度T℃、压强p kPa条件下进行反应。平衡时,若NO的转化率为50%,则该条件下的平衡常数Kp=___________ kPa−1(以分压表示,分压=总压×物质的量分数)。
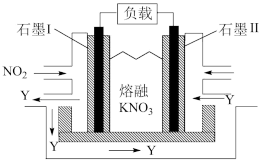
(4)NO2、O2和熔融KNO3可制作燃料电池,其原理如下图所示。该电池在放电过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用。则正极反应方程式为___________ 。
(1)NO被氧化的机理如下:第一步:NO+O2

①2NO(g)+O2(g) = 2NO2(g)的ΔH
②k1、k−1、k2为反应速率常数,若某反应包含多个基元反应(一步直接转化为产物的反应,如上述反应第一步与第二步均为基元反应),反应速率由最慢的一步基元反应决定,对于基元反应aA + bB=cC+dD,其速率方程为v(正)=kca(A)·cb(B)。上述第一步反应的平衡常数为
(2)在恒压反应器中充入NO、O2,当O2分别过量6%、20%和100%时,NO的平衡转化率α分别如图所示(图中虚线)。

①该压强下,400℃、O2过量100%时,NO的平衡转化率α =
②图中实线为相同时间内NO的转化率随温度的变化曲线,实线左侧,随温度升高,NO的转化率逐渐增大,其原因是
(3)若在恒压反应器中充入m mol NO和n mol O2,在温度T℃、压强p kPa条件下进行反应。平衡时,若NO的转化率为50%,则该条件下的平衡常数Kp=
(4)NO2、O2和熔融KNO3可制作燃料电池,其原理如下图所示。该电池在放电过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用。则正极反应方程式为

21-22高三上·重庆沙坪坝·阶段练习
类题推荐
氮的氧化物是大气污染物之一,研究氮氧化物的反应机理对缓解环境污染有重要意义,回答下列问题。
(1)碘蒸气的存在能大幅度提高N2O的分解速率,反应历程为:
第一步:I2(g)→2I(g) (快反应)
第二步:I(g)+N2O(g)→N2(g)+IO(g) (慢反应)
第三步:IO(g)+N2O(g)→N2(g)+O2(g)+I2(g) (快反应)
实验表明:含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是___________
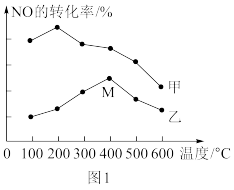
(2)为探究温度及不同催化剂对反应2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=-746.5kJ/mol的影响,分别在不同温度、不同催化剂下,保持其它初始条件不变重复实验,在相同时间内测得NO转化率与温度的关系如图1所示。在催化剂乙作用下,图中M点对应的速率(对应温度400°C)v(正)
N2(g)+2CO2(g) ΔH=-746.5kJ/mol的影响,分别在不同温度、不同催化剂下,保持其它初始条件不变重复实验,在相同时间内测得NO转化率与温度的关系如图1所示。在催化剂乙作用下,图中M点对应的速率(对应温度400°C)v(正)___________ v(逆)(填“>”、“<”或“=”),温度升高后,两种催化剂条件下NO转化效率均明显降低,原因可能是___________ 。
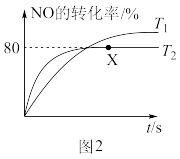
(3)实验发现,NO易发生二聚反应2NO(g) N2O2(g)。向某恒容的容器中充入一定量的NO进行反应,测得温度分别为T1和T2时NO的转化率随时间变化的结果如图2所示。则T1
N2O2(g)。向某恒容的容器中充入一定量的NO进行反应,测得温度分别为T1和T2时NO的转化率随时间变化的结果如图2所示。则T1___________ T2(填“>”、“<”或“=”)。温度为T2时,达到平衡时体系的总压强为200kPa,X点对应的平衡常数Kp=___________ kPa-1(用分压表示);提高NO平衡转化率的条件为___________ (写出其中一点)。
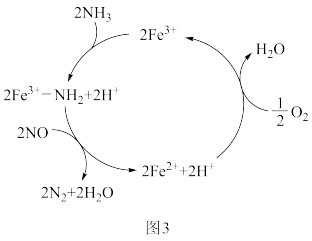
(4)NH3催化还原NO是重要的烟气脱硝技术,研究发现以Fe3+为主体催化剂时可能发生的反应过程如图3,写出脱硝过程总反应的化学方程式:___________ 。
(1)碘蒸气的存在能大幅度提高N2O的分解速率,反应历程为:
第一步:I2(g)→2I(g) (快反应)
第二步:I(g)+N2O(g)→N2(g)+IO(g) (慢反应)
第三步:IO(g)+N2O(g)→N2(g)+O2(g)+I2(g) (快反应)
实验表明:含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是___________
| A.升高温度,第一步向右进行的程度变大 |
| B.第二步的活化能比第三步小 |
| C.IO为反应的催化剂 |
| D.N2O分解反应的速率与是否含碘蒸气有关 |

(3)实验发现,NO易发生二聚反应2NO(g)

(4)NH3催化还原NO是重要的烟气脱硝技术,研究发现以Fe3+为主体催化剂时可能发生的反应过程如图3,写出脱硝过程总反应的化学方程式:

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网






