解答题-原理综合题 适中0.65 引用1 组卷297
用CO2和H2在一定条件下可转化生成甲醇蒸气和水蒸CO2(g)+3H2(g) CH3OH(g)+H2O(g);ΔH=-akJ/mol
CH3OH(g)+H2O(g);ΔH=-akJ/mol
(1)已知:①3CO(g)+3H2(g) CH3OCH3(g)+CO2(g) ΔH=-247kJ/mol
CH3OCH3(g)+CO2(g) ΔH=-247kJ/mol
②2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH=-24kJ/mol
CH3OCH3(g)+H2O(g) ΔH=-24kJ/mol
③CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41kJ/mol
CO2(g)+H2(g) ΔH=-41kJ/mol
则a=___________ 。
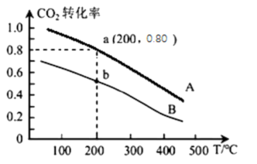
(2)CO2在不同温度下的平衡转化率与压强的关系如下图所示。请写出T1、T2、T3三者的大小关系___________ ,实际生产条件控制在T1、1.3×104kPa左右,选择此压强的理由是___________ 。
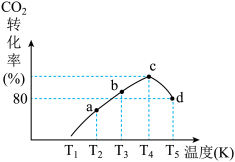
(3)一定条件下,在相同体积的恒容密闭容器中充入1.0molCO2和3.0molH2,相同时间段内测得CO2的转化率随温度变化如图所示:b点v正___________ v逆(填“>”“<”或“=”);温度高于T4,CO2的转化率降低的原因是___________ 。已知容器内的起始压强为200kPa,则图中d点对应温度下反应的平衡常数Kp=___________ (kPa)-2(结果保留两位有效数字)(KP为以分压表示的平衡常数,分压=总压×物质的量分数)
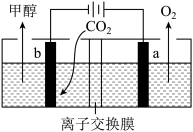
(4)用惰性电极电解强酸性的二氧化碳水溶液可得到甲醇,其原理如下图所示。
①b电极上的电极反应式为___________ ;
②该装置中使用的是___________ (填“阳”或“阴”)离子交换膜。
(1)已知:①3CO(g)+3H2(g)
②2CH3OH(g)
③CO(g)+H2O(g)
则a=
(2)CO2在不同温度下的平衡转化率与压强的关系如下图所示。请写出T1、T2、T3三者的大小关系

(3)一定条件下,在相同体积的恒容密闭容器中充入1.0molCO2和3.0molH2,相同时间段内测得CO2的转化率随温度变化如图所示:b点v正

(4)用惰性电极电解强酸性的二氧化碳水溶液可得到甲醇,其原理如下图所示。
①b电极上的电极反应式为
②该装置中使用的是

20-21高一下·重庆沙坪坝·期末
类题推荐
随着我国碳达峰、碳中和目标的确定,二氧化碳资源化利用倍受关注。
Ⅰ.以CO2和NH3为原料合成尿素反应分两步完成,
第一步:2NH3(g)+CO2(g) NH2COONH4(s) ∆H1=-159.5kJ/mol
NH2COONH4(s) ∆H1=-159.5kJ/mol
第二步:NH2COONH4(s) CO(NH2)2(s)+H2O(g) ∆H2=+72kJ/mol
CO(NH2)2(s)+H2O(g) ∆H2=+72kJ/mol
(1)2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) ∆H=
CO(NH2)2(s)+H2O(g) ∆H=_______ 。
(2)有利于提高CO2平衡转化率的措施是_______ (填序号)。
(3)合成尿素其能量变化如图甲所示:
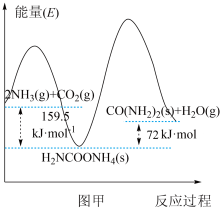
反应速率较快的是_______ 反应(填“第一步”或“第二步”),理由是_______ 。
Ⅱ.以CO2和CH4催化重整制备合成气:
(4)在密闭容器中通入物质的量均为0.2mol的CH4和CO2,在一定条件下发生反应CH4(g)+CO2(g) 2CO(g)+2H2(g),CH4的平衡转化率随温度、压强的变化关系如图乙所示。
2CO(g)+2H2(g),CH4的平衡转化率随温度、压强的变化关系如图乙所示。

①若反应在恒温、恒容密闭容器中进行,下列叙述能说明反应到达平衡状态的是_______ (填序号)。
A容器中混合气体的密度保持不变
B.容器内混合气体的压强保持不变
C.反应速率:2v正(CO2)=v正(H2)
D.同时断裂2molC-H键和1molH-H键
②由图乙可知,压强P1_______ P2(填“>”“<”或“=”,下同);Y点速率v正_______ v逆。
③已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数Kp,则X点对应温度下的Kp=_______ (用含P2的代数式表示)。
Ⅲ.电化学法还原二氧化碳制乙烯
在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图丙所示:
(5)阴极电极反应式为_______ ,该装置中使用的是_______ (填“阴”或“阳”)离子交换膜。

Ⅰ.以CO2和NH3为原料合成尿素反应分两步完成,
第一步:2NH3(g)+CO2(g)
第二步:NH2COONH4(s)
(1)2NH3(g)+CO2(g)
(2)有利于提高CO2平衡转化率的措施是
| A.高温低压 | B.低温高压 | C.高温高压 | D.低温低压 |

反应速率较快的是
Ⅱ.以CO2和CH4催化重整制备合成气:
(4)在密闭容器中通入物质的量均为0.2mol的CH4和CO2,在一定条件下发生反应CH4(g)+CO2(g)

①若反应在恒温、恒容密闭容器中进行,下列叙述能说明反应到达平衡状态的是
A容器中混合气体的密度保持不变
B.容器内混合气体的压强保持不变
C.反应速率:2v正(CO2)=v正(H2)
D.同时断裂2molC-H键和1molH-H键
②由图乙可知,压强P1
③已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数Kp,则X点对应温度下的Kp=
Ⅲ.电化学法还原二氧化碳制乙烯
在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图丙所示:
(5)阴极电极反应式为

研究氮氧化物、碳氧化物的产生及利用有重要的化学意义。回答下列问题:
(1)汽车燃料中不含氮元素,汽车尾气中所含NO产生的原因是____________________________ 。反应 的平衡常数约为
的平衡常数约为 ,从热力学角度看,该反应程度应该很大,实际汽车尾气中该反应的程度很小,原因是
,从热力学角度看,该反应程度应该很大,实际汽车尾气中该反应的程度很小,原因是________________________ ,要增大汽车尾气净化装置中该反应的程度,关键是要________________ 。
(2)将SrCO3放入密闭的真空容器中,发生反应SrCO3(s)⇌SrCO3(s)+CO2(g),反应达到平衡时c(CO2)为x mol/L,如反应温度不变,将反应体系的体积快速压缩为原来的一半,则c(CO2)的变化范围为________________________________________ 。
(3)用CO2和H2在一定条件下可转化生成甲醇蒸气和水蒸气:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H
已知部分化学键键能如下表所示:
①
________  ;
;
②一定条件下,在相同体积的恒容密闭容器中充入1.0mol CO2和3.0mol H2,相同时间段内测得CO2的转化率随温度变化如图所示:
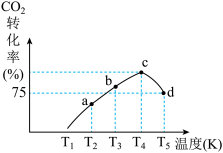
d点v正________ v逆(填“>”“<”或“=”)。b点CO2的转化率比a点高的原因是________________ 已知容器内的起始压强为160kPa,则图中d点对应温度下反应的平衡常数Kp=______ kPa-2(KP为以分压表示的平衡常数,分压=总压×物质的量分数)
(1)汽车燃料中不含氮元素,汽车尾气中所含NO产生的原因是
(2)将SrCO3放入密闭的真空容器中,发生反应SrCO3(s)⇌SrCO3(s)+CO2(g),反应达到平衡时c(CO2)为x mol/L,如反应温度不变,将反应体系的体积快速压缩为原来的一半,则c(CO2)的变化范围为
(3)用CO2和H2在一定条件下可转化生成甲醇蒸气和水蒸气:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H
已知部分化学键键能如下表所示:
| 化学键 | H-H | C=O | C-O | H-O | C-H |
| E/(kJ·mol-1) | 436 | 745 | 351 | 463 | 413 |
②一定条件下,在相同体积的恒容密闭容器中充入1.0mol CO2和3.0mol H2,相同时间段内测得CO2的转化率随温度变化如图所示:

d点v正
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网