解答题-原理综合题 较难0.4 引用1 组卷204
源开发和利用是科学研究的热点课题。
(1)几个有关CO的热化学方程式如下:
I.CO(g)+2H2(g)⇌CH3OH(g) ∆H1
II.2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ∆H2
III.CO(g)+H2O(g)⇌CO2(g)+H2(g) ∆H3
则3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g) ∆H=_______ (用含∆H1、∆H2、∆H3的代数表示)。
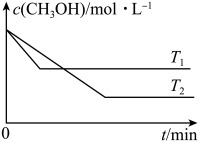
(2)在1L恒容密闭容器中充入一定量CH3OH发生反应:2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ∆H,测得CH3OH的浓度与温度的关系如图所示:
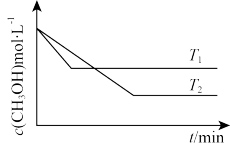
则T1_______ T2;∆H_______ 0(填“>”“<”或“=”)。
(3)工业上,利用水煤气合成CH3OH的反应表示如下:2H2(g)+CO(g)⇌CH3OH(g) ∆H=-91.0kJ·mol-1,向1L的恒容密容器中加入0.1molH2和0.05molCO在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出的热量为3.64kJ。
①从反应开始恰好平衡状态时,H2的平均反应速率v(H2)为_______ 。
②在温度不变条件下,上述反应达到平衡后再向容器中充入0.01molH2和0.05molCH3OH(g)时,平衡_______ (填“向左移动”、“向右移动”或“不移动”)。
(4)探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
I.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H=-49.5kJ·mol-1
II.CO(g)+2H2(g)⇌CH3OH(g) ∆H2=-90.4kJ·mol-1
III.CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H3
一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和3molH2发生上述反应,达到平衡时,容器中CH3OH(g)为amol,CO为bmol,此时H2O(g)的浓度为_______ mol·L-1(用含a、b、V的代数式表示,下同),反应III的平衡常数为_______ 。
(1)几个有关CO的热化学方程式如下:
I.CO(g)+2H2(g)⇌CH3OH(g) ∆H1
II.2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ∆H2
III.CO(g)+H2O(g)⇌CO2(g)+H2(g) ∆H3
则3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g) ∆H=
(2)在1L恒容密闭容器中充入一定量CH3OH发生反应:2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ∆H,测得CH3OH的浓度与温度的关系如图所示:

则T1
(3)工业上,利用水煤气合成CH3OH的反应表示如下:2H2(g)+CO(g)⇌CH3OH(g) ∆H=-91.0kJ·mol-1,向1L的恒容密容器中加入0.1molH2和0.05molCO在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出的热量为3.64kJ。
①从反应开始恰好平衡状态时,H2的平均反应速率v(H2)为
②在温度不变条件下,上述反应达到平衡后再向容器中充入0.01molH2和0.05molCH3OH(g)时,平衡
(4)探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
I.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H=-49.5kJ·mol-1
II.CO(g)+2H2(g)⇌CH3OH(g) ∆H2=-90.4kJ·mol-1
III.CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H3
一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和3molH2发生上述反应,达到平衡时,容器中CH3OH(g)为amol,CO为bmol,此时H2O(g)的浓度为
20-21高一下·湖南岳阳·期末
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网