解答题-原理综合题 适中0.65 引用1 组卷166
NOx是形成雾霾天气的主要原因之一,以NOx为主的污染综合治理是当前重要的研究课题。
(1)通常可采用氢气进行催化还原,消除NO造成的污染。
已知:①N2(g)+O2(g)=2NO(g) ∆H=akJ·mol-1;
②2H2(g)+O2(g)=2H2O(l) ∆H=bkJ·mol-1;
③H2O(g)=H2O(l) ∆H=ckJ·mol-1。
写出H2与NO反应生成N2和水蒸气的热化学方程式:___________ 。
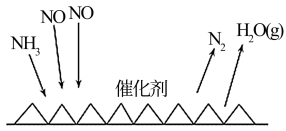
(2)用NH3催化还原氮氧化物(SCR)技术是常见的烟气氮氧化物脱除技术。反应原理如图所示。当NO2与NO的物质的量之比为1∶1时,与足量氨气在一定条件下发生反应。当有15mol电子发生转移时,则参与反应的NO的物质的量为___________ 。
(3)可用电解法将硝酸工业的尾气NO转变为NH4NO3,其工作原理如图:
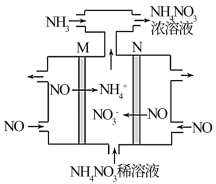
M极接电源的___________ 极,N极的电极反应式为___________ 。
(4)汽车尾气中的NO、以NO为主,净化的主要原理为:2NO(g)+2CO(g) 2CO2(g)+N2(g)∆H=akJ·mol-1,在500℃时,向恒容密闭体系中通入5mol的NO和5mol的CO进行反应时,体系中压强与时间的关系如图所示:
2CO2(g)+N2(g)∆H=akJ·mol-1,在500℃时,向恒容密闭体系中通入5mol的NO和5mol的CO进行反应时,体系中压强与时间的关系如图所示:

500℃时的平衡常数Kp=___________ Mpa-1,(Kp为以平衡分压表示的平衡常数,平衡分压=总压×物质的量分数)。若在4min改变的条件为升高温度,Kp减小,则a___________ 0(填“大于”“小于”或“等于”)。
(1)通常可采用氢气进行催化还原,消除NO造成的污染。
已知:①N2(g)+O2(g)=2NO(g) ∆H=akJ·mol-1;
②2H2(g)+O2(g)=2H2O(l) ∆H=bkJ·mol-1;
③H2O(g)=H2O(l) ∆H=ckJ·mol-1。
写出H2与NO反应生成N2和水蒸气的热化学方程式:
(2)用NH3催化还原氮氧化物(SCR)技术是常见的烟气氮氧化物脱除技术。反应原理如图所示。当NO2与NO的物质的量之比为1∶1时,与足量氨气在一定条件下发生反应。当有15mol电子发生转移时,则参与反应的NO的物质的量为

(3)可用电解法将硝酸工业的尾气NO转变为NH4NO3,其工作原理如图:

M极接电源的
(4)汽车尾气中的NO、以NO为主,净化的主要原理为:2NO(g)+2CO(g)

500℃时的平衡常数Kp=
20-21高二下·江苏苏州·阶段练习
类题推荐
经最新研究发现,NOx和SOx是形成雾霾天气的主要原因之一,因此研究NOx、SOx等大气污染物的妥善处理具有重要意义。
(1)为了消除NO造成的污染,通常采用一氧化碳和氢气进行催化还原NO。
已知:①N2(g)+O2(g)=2NO(g) ΔH=akJ•mol-1;
②2H2(g)+O2(g)=2H2O(l) ΔH=bkJ•mol-1;
③H2O(g)=H2O(l) ΔH=ckJ•mol-1。
写出H2与NO反应生成N2和水蒸气的热化学方程式:________________________ 。
(2)目前应用最广泛的烟气氮氧化物脱除技术是NH3催化还原氮氧化物(SCR)技术。反应原理如图所示:
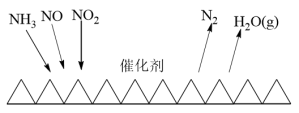
当NO2与NO的物质的量之比为1:1时,与足量氨气在一定条件下发生反应。当有12mol电子发生转移时,则参与反应的NO2的物质的量为________ 。
(3)T1温度时在容积为2L的恒容密闭容器中发生反应:2NO(g)+O2(g) 2NO2(g) ΔH<0。实验测得:v正=v消耗(NO)=2v消耗(O2)=k正c2(NO)•c(O2),v逆=v消耗(NO2)=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:
2NO2(g) ΔH<0。实验测得:v正=v消耗(NO)=2v消耗(O2)=k正c2(NO)•c(O2),v逆=v消耗(NO2)=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:
①从0~2s该反应的平均速率v(NO2)=________ mol/(L•s)。
②T1温度时,上述反应的化学平衡常数K=________ 。
③若将容器的温度改变为T2时其k正=k逆,则T1________ T2(填“ ”“
”“ ”或“
”或“ ”)。
”)。
(4)电解硝酸工业的尾气NO可制备NH4NO3,其工作原理如图。
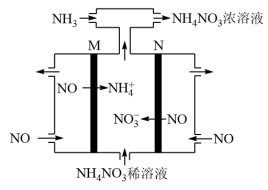
①N极的电极反应式为________________________ 。
②将电解生成的HNO3全部转化为NH4NO3,则通入的NH3与实际参加反应的NO的物质的量之比至少为________ 。
(1)为了消除NO造成的污染,通常采用一氧化碳和氢气进行催化还原NO。
已知:①N2(g)+O2(g)=2NO(g) ΔH=akJ•mol-1;
②2H2(g)+O2(g)=2H2O(l) ΔH=bkJ•mol-1;
③H2O(g)=H2O(l) ΔH=ckJ•mol-1。
写出H2与NO反应生成N2和水蒸气的热化学方程式:
(2)目前应用最广泛的烟气氮氧化物脱除技术是NH3催化还原氮氧化物(SCR)技术。反应原理如图所示:

当NO2与NO的物质的量之比为1:1时,与足量氨气在一定条件下发生反应。当有12mol电子发生转移时,则参与反应的NO2的物质的量为
(3)T1温度时在容积为2L的恒容密闭容器中发生反应:2NO(g)+O2(g)
| 时间/ | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 1 | 0.6 | 0.4 | 0.2 | 0.2 | 0.2 |
| n(O2)/mol | 0.6 | 0.4 | 0.3 | 0.2 | 0.2 | 0.2 |
①从0~2s该反应的平均速率v(NO2)=
②T1温度时,上述反应的化学平衡常数K=
③若将容器的温度改变为T2时其k正=k逆,则T1
(4)电解硝酸工业的尾气NO可制备NH4NO3,其工作原理如图。

①N极的电极反应式为
②将电解生成的HNO3全部转化为NH4NO3,则通入的NH3与实际参加反应的NO的物质的量之比至少为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网