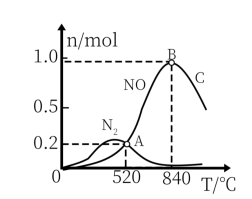
解答题-原理综合题 适中0.65 引用1 组卷139
氨气及其相关产品在化工领域中具有重要作用。回答下列问题:
(1)以 和
和 为原料生产尿素
为原料生产尿素 ,发生反应的化学方程式为
,发生反应的化学方程式为
 。
。
①该反应每消耗 ,放出
,放出 热量,则
热量,则
________  。
。
②为了提高尿素的产率,下列措施可行的是________ (填标号)。
A.升高温度 B.增大压强 C.加入合适的催化剂 D.及时移除部分
(2)某温度下,向恒容密闭容器中通入 、
、 两种原料气,使之发生上述反应。
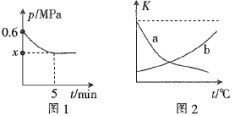
两种原料气,使之发生上述反应。 后,反应达到平衡,此时得到的尿素质量为
后,反应达到平衡,此时得到的尿素质量为 ,容器内的压强(
,容器内的压强( )随时间(
)随时间( )的变化如图1所示。
)的变化如图1所示。
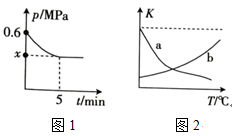
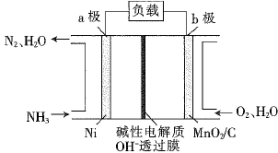
①保持其他条件不变,图2中能正确反映平衡常数 随温度的变化关系的曲线是
随温度的变化关系的曲线是________ (填标号)。
②反应达到平衡后,
________ ,平衡常数
________  (以分压表示,分压=总压×物质的量分数)。
(以分压表示,分压=总压×物质的量分数)。
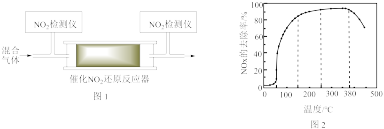
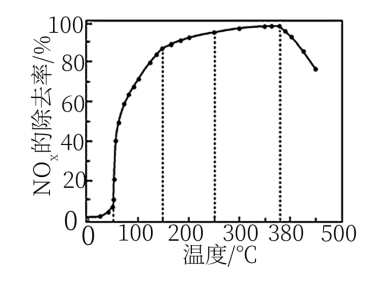
(3)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。将以一定比例混合的O2、NH3和NOx的混合气体匀速通入装有催化剂M的反应器中反应。反应相同时间,NOx的去除率随反应温度的变化曲线如图3所示。
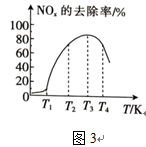
① 范围内,随着温度的升高,NOx的去除率迅速升高的原因是
范围内,随着温度的升高,NOx的去除率迅速升高的原因是________ 。
②当温度高于 时,NOx的去除率迅速下降的原因可能是
时,NOx的去除率迅速下降的原因可能是________ 。
③已知反应器中发生的反应为放热反应,则在温度处于________ (填“ ”、“
”、“ ”或“
”或“ ”)K时,该反应一定达到了平衡状态。
”)K时,该反应一定达到了平衡状态。
(1)以
①该反应每消耗
②为了提高尿素的产率,下列措施可行的是
A.升高温度 B.增大压强 C.加入合适的催化剂 D.及时移除部分
(2)某温度下,向恒容密闭容器中通入

①保持其他条件不变,图2中能正确反映平衡常数
②反应达到平衡后,
(3)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。将以一定比例混合的O2、NH3和NOx的混合气体匀速通入装有催化剂M的反应器中反应。反应相同时间,NOx的去除率随反应温度的变化曲线如图3所示。

①
②当温度高于
③已知反应器中发生的反应为放热反应,则在温度处于
20-21高二下·贵州黔西·期末
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网