解答题-原理综合题 较难0.4 引用1 组卷348
I.H2(g)和CH3OH(l)的燃烧热分别为285.8 和726.5
和726.5 ,则由H2(g)和CO2(g)生成液态甲醇和液态水的热化学方程式为
,则由H2(g)和CO2(g)生成液态甲醇和液态水的热化学方程式为___________ 。
Ⅱ.如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
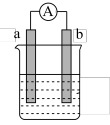
(1)当电极a为Al,电极b为Cu,电解质溶液为稀硫酸时,正极的电极反应式为___________ ,H+移向___________ 极(填“a”或“b”)。
(2)利用反应“Cu+2Ag+=2Ag+Cu2+”设计一个化学电池,该电池的电解质溶液是___________ 。
Ⅲ.在温度不变的条件下,密闭容器中发生如下反应2SO2(g)+O2(g) 2SO3(g)。
2SO3(g)。
(1)温度恒容条件下,O2的浓度在2min内由0.4mol/L变成了0.1mol/L,则由SO2表示的这段时间内反应的平均速率为___________ mol/(L·min);
(2)若压缩气体体积以增大压强,该反应的反应速率将___________ (填“增大”“减小”或“不变”)。
Ⅳ.在1.0L密闭容器中放入0.10molA(g),在一定温度进行如下反应:A(g) B(g)+C(g),吸热反应,反应时间(t)与容器内气体总压强(p)的数据见表:
B(g)+C(g),吸热反应,反应时间(t)与容器内气体总压强(p)的数据见表:
回答下列问题:
(1)判断正误:第25分钟时反应体系处于化学平衡状态___________ 。(填“对”或“错”)
(2)由总压强P和起始压强P0计算反应物A的平衡转化率α(A)=___________ (保留一位小数)。
Ⅱ.如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:

(1)当电极a为Al,电极b为Cu,电解质溶液为稀硫酸时,正极的电极反应式为
(2)利用反应“Cu+2Ag+=2Ag+Cu2+”设计一个化学电池,该电池的电解质溶液是
Ⅲ.在温度不变的条件下,密闭容器中发生如下反应2SO2(g)+O2(g)
(1)温度恒容条件下,O2的浓度在2min内由0.4mol/L变成了0.1mol/L,则由SO2表示的这段时间内反应的平均速率为
(2)若压缩气体体积以增大压强,该反应的反应速率将
Ⅳ.在1.0L密闭容器中放入0.10molA(g),在一定温度进行如下反应:A(g)
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)判断正误:第25分钟时反应体系处于化学平衡状态
(2)由总压强P和起始压强P0计算反应物A的平衡转化率α(A)=
20-21高一下·湖南衡阳·期末
类题推荐
根据所学知识,回答下列问题:
(1)分析下面的能量变化图,则C(s)+H2O(g)=CO(g)+H2(g)为____ (填“吸热”或“放热”)反应。下列化学反应的能量变化与C(s)+H2O(g)=CO(g)+H2(g)的能量变化相同的是____ (填标号)。

A.稀硫酸与NaOH溶液的反应 B.点燃的镁条在氮气中继续燃烧
C.灼热的炭与二氧化碳的反应 D.Ba(OH)2·8H2O与NH4Cl的反应
(2)断裂1molH—H键、1molN—H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则生成2molNH3放出的热量为____ kJ。
(3)在温度不变的条件下,密闭容器中发生反应2SO2(g)+O2(g) 2SO3(g)。
2SO3(g)。
①恒容条件下,O2的浓度在2min内由0.4mol/L变成0.1mol/L,则由SO2表示的这段时间内反应的平均速率为___ mol/(L·min)。
②若压缩气体体积以增大压强,则该反应的反应速率将____ (填“加快”、“减慢”或“不变”)。
(4)一定温度下,在容积为1.0L的恒容密闭容器中放入0.10molPCl5(g),在一定温度下进行反应:PCl5(g) PCl3(g)+Cl2(g),该反应为吸热反应,反应时间(t)与容器内气体总压强(p)的数据见表:
PCl3(g)+Cl2(g),该反应为吸热反应,反应时间(t)与容器内气体总压强(p)的数据见表:
①上述反应体系处于化学平衡状态的时间段是___ (填“4~8”、“16~20”“20~25”或“25~30”)h。
②下列可以说明该反应达到平衡的是___ (填标号)。
A.c(PCl5):c(PCl3):c(Cl2)=1:1:1 B.v(PCl5)=v(PCl3)
C.容器内气体的颜色不再变化 D.混合气体的密度不再变化
③结合上述转化的化学方程式,说明在恒温恒容条件下反应体系压强增大的原因:___ 。
④用总压强p和起始压强p0计算反应物PCl5的平衡转化率,则α(PCl5)=____ (保留三位有效数字)。
(1)分析下面的能量变化图,则C(s)+H2O(g)=CO(g)+H2(g)为

A.稀硫酸与NaOH溶液的反应 B.点燃的镁条在氮气中继续燃烧
C.灼热的炭与二氧化碳的反应 D.Ba(OH)2·8H2O与NH4Cl的反应
(2)断裂1molH—H键、1molN—H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则生成2molNH3放出的热量为
(3)在温度不变的条件下,密闭容器中发生反应2SO2(g)+O2(g)
①恒容条件下,O2的浓度在2min内由0.4mol/L变成0.1mol/L,则由SO2表示的这段时间内反应的平均速率为
②若压缩气体体积以增大压强,则该反应的反应速率将
(4)一定温度下,在容积为1.0L的恒容密闭容器中放入0.10molPCl5(g),在一定温度下进行反应:PCl5(g)
| t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
②下列可以说明该反应达到平衡的是
A.c(PCl5):c(PCl3):c(Cl2)=1:1:1 B.v(PCl5)=v(PCl3)
C.容器内气体的颜色不再变化 D.混合气体的密度不再变化
③结合上述转化的化学方程式,说明在恒温恒容条件下反应体系压强增大的原因:
④用总压强p和起始压强p0计算反应物PCl5的平衡转化率,则α(PCl5)=
氮及其化合物在工农业生产、生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一,
(1)已知:N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ·mol-l
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-l
2C(s)+O 2(g)=2CO(g) ΔH=-221kJ·mol-l
若某反应的平衡常数表达式为:K= ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式 ___________ 。
(2)N2O5在一定条件下可发生分解:2N2O5(g) 4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
①反应开始时体系压强为P0,第3.00 min时体系压强为p1,则p1:p0= ___________ ;2.00min~5.00 min内,O2的平均反应速率为___________ 。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是___________ 。
a.容器中压强不再变化 b.NO2和O2的体积比保持不变
c.2v正(NO2)=v逆(N2O5) d.气体的平均相对分子质量为43.2,且保持不变
(3)N2O4与NO2 之间存在反应:N2O4(g) 2NO2(g) ΔH=QkJ·mol-1。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
2NO2(g) ΔH=QkJ·mol-1。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
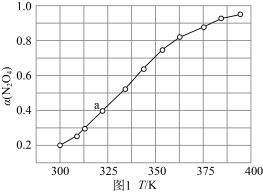
如图中a点对应温度下,已知N2O4的起始压强p0为200 kPa,该温度下反应的平衡常数Kp=___________ (小数点后保留一位数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
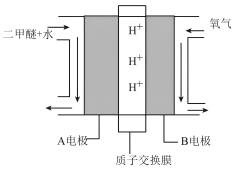
(4)绿色电源“直接二甲醚CH3OCH3(g)燃料电池”的工作原理示意图如图所示:正极为___________ (填“A电极”或“B电极”),写出A电极的电极反应式:___________ 。
(1)已知:N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ·mol-l
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-l
2C(s)+O 2(g)=2CO(g) ΔH=-221kJ·mol-l
若某反应的平衡常数表达式为:K=
(2)N2O5在一定条件下可发生分解:2N2O5(g)
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c(N2O5)/(mol/L) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是
a.容器中压强不再变化 b.NO2和O2的体积比保持不变
c.2v正(NO2)=v逆(N2O5) d.气体的平均相对分子质量为43.2,且保持不变
(3)N2O4与NO2 之间存在反应:N2O4(g)

如图中a点对应温度下,已知N2O4的起始压强p0为200 kPa,该温度下反应的平衡常数Kp=
(4)绿色电源“直接二甲醚CH3OCH3(g)燃料电池”的工作原理示意图如图所示:正极为

I.依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计原电池如图所示。(盐桥为装有琼脂和KNO3的U形管)。请回答下列问题:

(1)电极X的材料是______ ;电解质溶液Y是_______ ;
(2)银电极为电池的______ 极,发生的电极反应为______ ;
(3)盐桥中的K+移向_______ (填“CuSO4”或“Y”)中的溶液。
Ⅱ.CH4可以消除氮氧化物的污染,主要反应原理为CH4(g)+2NO2(g)⇌CO2(g)+2H2O(g)+N2(g) ∆H=-868.7kJ·mol-1;在3.00L密闭容器中通入1molCH4和2molNO2,在一定温度下进行上述反应,反应时间(t)与容器内气体总压强(P)的数据见表(提示:恒温恒容条件下压强与气体的物质的量成正比):
由表中数据计算,达到平衡时NO2的转化率为________ ,该温度下的平衡常数K=__________ 。

(1)电极X的材料是
(2)银电极为电池的
(3)盐桥中的K+移向
Ⅱ.CH4可以消除氮氧化物的污染,主要反应原理为CH4(g)+2NO2(g)⇌CO2(g)+2H2O(g)+N2(g) ∆H=-868.7kJ·mol-1;在3.00L密闭容器中通入1molCH4和2molNO2,在一定温度下进行上述反应,反应时间(t)与容器内气体总压强(P)的数据见表(提示:恒温恒容条件下压强与气体的物质的量成正比):
| 反应时间 t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| 总压强 P/100kPa | 4.8 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


