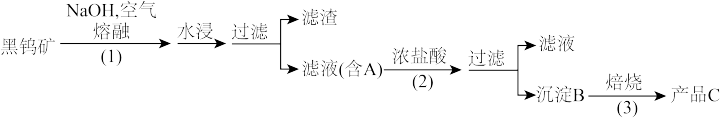解答题-无机推断题 适中0.65 引用1 组卷44
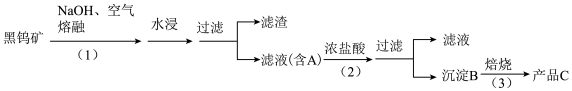
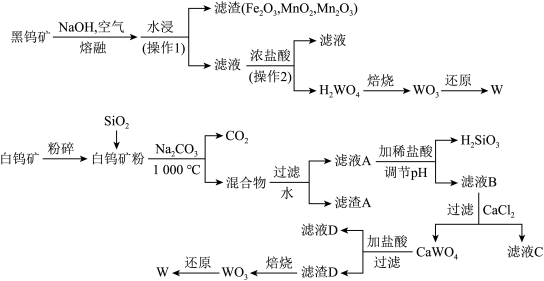
钨是我国丰产元素,是熔点最高的金属,广泛用于拉制灯泡的灯丝,有“光明使者”的美誉。钨在自然界主要以钨(VI)酸盐的形式存在。有开采价值的钨矿石是白钨矿和黑钨矿。白钨矿的主要成分是钨酸钙(CaWO4);黑钨矿的主要成分是铁和锰的钨酸盐,化学式常写成(Fe,Mn)WO4。黑钨矿传统冶炼工艺的第一阶段是碱熔法:
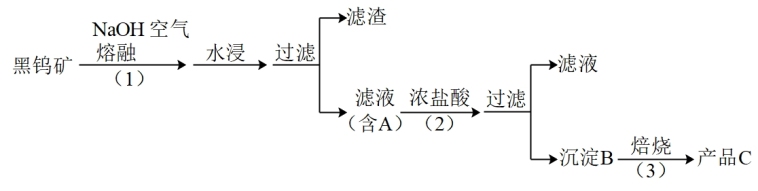
其中A、B、C都是钨的化合物。
(1)写出上述流程中A、B、C的化学式:A_______ 、B_______ 、C_______ ,以及步骤(1)、(2)、(3)中发生反应的化学方程式(1)_______ 、(2)_______ 、(3)_______ 。
(2)钨冶炼工艺的第二阶段则是用碳、氢等还原剂把氧化钨还原为金属钨。对钨的纯度要求不高时,可用碳作还原剂。
①写出用碳还原氧化钨制取金属钨的化学方程式_______ 。
②用下表所给的298.15K的数据计算上述反应的标准自由能变化。推出该反应在什么温度条件下能自发进行_______ 。(假设表中数据不随温度变化)
(3)为了获得可以拉制灯丝的高纯度金属钨,不宜用碳而必须用氢气作还原剂,为什么_______ ?写出用氢气还原氧化钨的化学方程式_______ 。
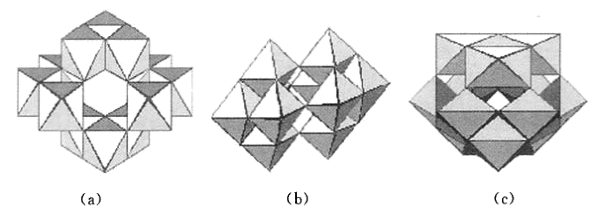
(4)在酸化钨酸盐的过程中,钨酸根WO 可能在不同程度上缩合形成多钨酸根。多钨酸根的组成常因溶液的酸度不同而不同,它们的结构都由含1个中心W原子和6个配位0原子的钨氧八面体WO6通过共顶或共边的方式形成。在为数众多的多钨酸根中,性质和结构了解得比较清楚的是仲钨酸根[H2W12O42]10-和偏钨酸根[H2Wl2O40]6-。在下面3张结构图中,哪一张是仲钨酸根的结构?简述判断理由
可能在不同程度上缩合形成多钨酸根。多钨酸根的组成常因溶液的酸度不同而不同,它们的结构都由含1个中心W原子和6个配位0原子的钨氧八面体WO6通过共顶或共边的方式形成。在为数众多的多钨酸根中,性质和结构了解得比较清楚的是仲钨酸根[H2W12O42]10-和偏钨酸根[H2Wl2O40]6-。在下面3张结构图中,哪一张是仲钨酸根的结构?简述判断理由_______ 。
(5)仲钨酸的肼盐在热分解时会发生内在氧化还原反应,我国钨化学研究的奠基人顾翼东先生采用这一反应制得了蓝色的非整比的钨氧化物WO3-x。这种蓝色氧化钨具有比表面大、易还原的优点,在制钨粉时温度容易控制,目前冶炼拉制钨丝的金属钨都用蓝色氧化钨为原料。经分析,得知蓝色氧化钨中钨的质量分数为0.7985。
①计算WO3-x中的x值_______ 。
②一般认为,蓝色氧化钨的颜色和非整比暗示了在化合物中存在五价和六价2种价态的钨。试计算蓝色氧化钨中这2种价态的钨原子数比_______ 。(相对原子质量:W-183.84;O-16.00)

其中A、B、C都是钨的化合物。
(1)写出上述流程中A、B、C的化学式:A
(2)钨冶炼工艺的第二阶段则是用碳、氢等还原剂把氧化钨还原为金属钨。对钨的纯度要求不高时,可用碳作还原剂。
①写出用碳还原氧化钨制取金属钨的化学方程式
②用下表所给的298.15K的数据计算上述反应的标准自由能变化。推出该反应在什么温度条件下能自发进行
| 物质 | ||
| W(s) WO3(s) C(石墨) CO(g) CO2(g) H2(g) H2O(g) H2O(l) | 0 -842.87 0 -110.52 -393.51 0 -241.82 -285.31 | 32.64 75.90 5.74 197.56 213.64 130.57 188.72 69.90 |
(4)在酸化钨酸盐的过程中,钨酸根WO

(5)仲钨酸的肼盐在热分解时会发生内在氧化还原反应,我国钨化学研究的奠基人顾翼东先生采用这一反应制得了蓝色的非整比的钨氧化物WO3-x。这种蓝色氧化钨具有比表面大、易还原的优点,在制钨粉时温度容易控制,目前冶炼拉制钨丝的金属钨都用蓝色氧化钨为原料。经分析,得知蓝色氧化钨中钨的质量分数为0.7985。
①计算WO3-x中的x值
②一般认为,蓝色氧化钨的颜色和非整比暗示了在化合物中存在五价和六价2种价态的钨。试计算蓝色氧化钨中这2种价态的钨原子数比
2007高三上·全国·竞赛
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网