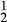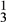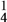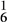解答题-工业流程题 适中0.65 引用2 组卷135
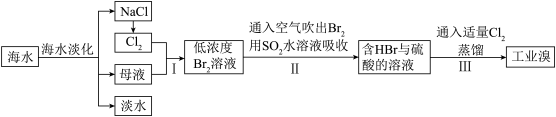
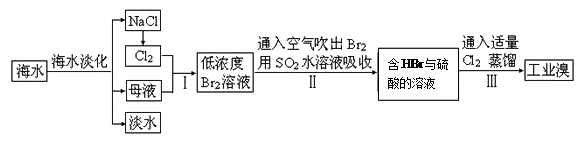
海水是巨大的资源宝库,甲工厂从海水中提取食盐和溴的工艺流程如图:
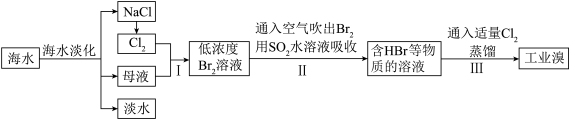
已知:Br2的沸点为59℃,微溶于水,有毒。
(1)海水淡化得到淡水的方法主要有___________ 。(写出两种即可)
(2)为了将粗盐(含杂质Mg2+、 、
、 )提纯,加入的试剂顺序可行的是
)提纯,加入的试剂顺序可行的是___________
A.NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸
C.NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
D.Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
(3)制备钠单质的方法之一是电解熔融NaCl,写出电解的化学方程式___________ 。
(4)步骤Ⅱ在此流程中作用是___________ 。
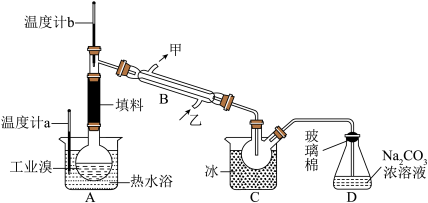
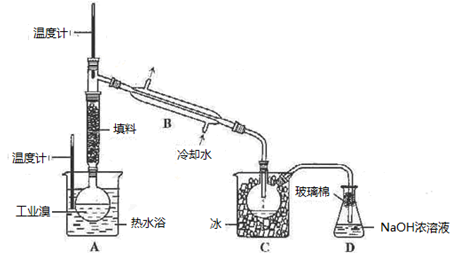
(5)乙工厂在甲工厂的流程设计基础上进行了改进,步骤Ⅱ中用Na2CO3溶液吸收空气中Br2.充分反应后,得到含NaBr、NaBrO3等物质的混合溶液。步骤Ⅲ向所得溶液中滴加稀硫酸,蒸馏即得到液溴。请写出步骤Ⅲ滴加稀硫酸的离子方程式______________________ 。
(6)与甲工厂相比,乙工厂设计流程的优点为___________ 。

已知:Br2的沸点为59℃,微溶于水,有毒。
(1)海水淡化得到淡水的方法主要有
(2)为了将粗盐(含杂质Mg2+、
A.NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸
C.NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
D.Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
(3)制备钠单质的方法之一是电解熔融NaCl,写出电解的化学方程式
(4)步骤Ⅱ在此流程中作用是
(5)乙工厂在甲工厂的流程设计基础上进行了改进,步骤Ⅱ中用Na2CO3溶液吸收空气中Br2.充分反应后,得到含NaBr、NaBrO3等物质的混合溶液。步骤Ⅲ向所得溶液中滴加稀硫酸,蒸馏即得到液溴。请写出步骤Ⅲ滴加稀硫酸的离子方程式
(6)与甲工厂相比,乙工厂设计流程的优点为
20-21高一下·安徽黄山·期末
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网