解答题-原理综合题 适中0.65 引用2 组卷303
2021年6月17日,搭载神舟十二号载人飞船的长征二号F摇十二运载火箭,在酒泉卫星发射中心发射。该运载火箭推进物分为偏二甲基肼(C2H8N2)、四氧化二氮和液氢、液氧两种。
(1)氨热分解法制氢气,相关化学键的键能数据如下表所示:
由以上数据可求得2NH3(g)⇌N2(g)+3H2(g)∆H=_______ 。
(2)在298.15K、100kPa条件下,N2(g)、H2(g)和NH3(g)的摩尔热容分别为29.1、28.9和35.6J·K-1·mol-1(已知:摩尔热容是指单位物质的量的某种物质升高单位温度所需的热量)。N2(g)、H2(g)合成NH3(g)的能量随温度T的变化示意图合理的是_______ 。
A.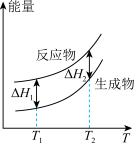 B.
B. 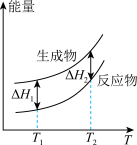 C.
C. 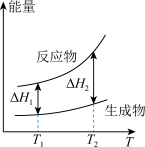 D.
D.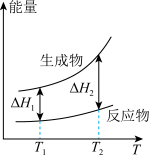
(3)甲烷水蒸气催化重整是制高纯氢的方法之一、反应器中存在如下反应:
i.CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH1
ii.CO(g)+H2O(g)=CO2(g)+H2(g)ΔH2
iii.C(s)+2H2O(g)=CO2(g)+2H2(g)ΔH3
iv.CH4(g)=C(s)+2H2(g)ΔH4
ⅳ为积炭反应,利用ΔH1、ΔH2和ΔH3,可计算ΔH4=_______ 。
(4)3.0g液态偏二甲基肼与足量液态四氧化二氮完全反应生成N2(g)、H2O(g)和CO2(g),放出112.5kJ的热量,写出上述反应的热化学方程式_______ 。
(5)对C2H8N2和N2O4反应的说法正确的是_______ 。
A.偏二甲肼是比液氢更环保的燃料
B.N2即是氧化产物,又是还原产物
C.偏二甲基肼的燃烧热为2250kJ/mol
D.偏二甲肼在四氧化二氮中的燃烧是放热反应
(1)氨热分解法制氢气,相关化学键的键能数据如下表所示:
| 化学键 | N≡N | H—H | N—H |
| 键能E(kJ/mol) | 946.0 | 436.0 | 390.8 |
(2)在298.15K、100kPa条件下,N2(g)、H2(g)和NH3(g)的摩尔热容分别为29.1、28.9和35.6J·K-1·mol-1(已知:摩尔热容是指单位物质的量的某种物质升高单位温度所需的热量)。N2(g)、H2(g)合成NH3(g)的能量随温度T的变化示意图合理的是
A.
 B.
B.  C.
C.  D.
D.
(3)甲烷水蒸气催化重整是制高纯氢的方法之一、反应器中存在如下反应:
i.CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH1
ii.CO(g)+H2O(g)=CO2(g)+H2(g)ΔH2
iii.C(s)+2H2O(g)=CO2(g)+2H2(g)ΔH3
iv.CH4(g)=C(s)+2H2(g)ΔH4
ⅳ为积炭反应,利用ΔH1、ΔH2和ΔH3,可计算ΔH4=
(4)3.0g液态偏二甲基肼与足量液态四氧化二氮完全反应生成N2(g)、H2O(g)和CO2(g),放出112.5kJ的热量,写出上述反应的热化学方程式
(5)对C2H8N2和N2O4反应的说法正确的是
A.偏二甲肼是比液氢更环保的燃料
B.N2即是氧化产物,又是还原产物
C.偏二甲基肼的燃烧热为2250kJ/mol
D.偏二甲肼在四氧化二氮中的燃烧是放热反应
20-21高一下·吉林长春·期末
类题推荐
2021年6月17日,搭载神舟十二号载人飞船的长征二号F遥十二运载火箭,在酒泉卫星发射中心发射。该运载火箭推进物分为偏二甲基肼( )、四氧化二氮和液氢、液氧。
)、四氧化二氮和液氢、液氧。
(1)3.0g液态偏二甲基肼与足量液态四氧化二氮完全反应生成 、
、 和
和 ,放出112.5kJ的热量,写出上述反应的热化学方程式
,放出112.5kJ的热量,写出上述反应的热化学方程式___________ 。
(2)对 和
和 反应的说法正确的是___________。
反应的说法正确的是___________。
(3)飞船在发射前,运载火箭要加注燃料,火箭的周围常常会看到淡淡的黄色烟雾。这是由于燃料推进时,需要减压排出部分 。无色的
。无色的 可分解为红棕色的
可分解为红棕色的 。
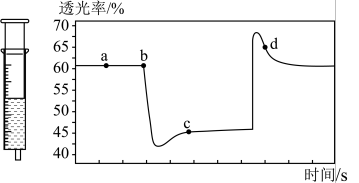
。 充入注射器中后封口,如图是在拉伸或压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法确的是
充入注射器中后封口,如图是在拉伸或压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法确的是___________ 。
B.b点的操作是压缩注射器
C.c点与a点相比, 增大,
增大, 减小
减小
D.若不忽略体系温度变化,且没有能量损失,则b、c两点的平衡常数
③反应 ,一定条件下
,一定条件下 与
与 的消耗速率与自身压强间存在:
的消耗速率与自身压强间存在: ,
, 。其中
。其中 、
、 是与反应及温度有关的常数。一定温度下,
是与反应及温度有关的常数。一定温度下, 、
、 与平衡常数
与平衡常数 的关系是
的关系是
___________ 。(对于气相反应,用某组分B的平衡压强 代替物质的量浓度
代替物质的量浓度 也可表示平衡常数,记作
也可表示平衡常数,记作 )
)
④反应温度 时,
时, 随t(时间)变化曲线如图1,画出
随t(时间)变化曲线如图1,画出 时段,
时段, 随t变化曲线。保持其它条件不变,改变反应温度为
随t变化曲线。保持其它条件不变,改变反应温度为 (
( ),再次画出
),再次画出 时段,
时段, 随t变化趋势的曲线。
随t变化趋势的曲线。_________
(1)3.0g液态偏二甲基肼与足量液态四氧化二氮完全反应生成
(2)对
| A.偏二甲肼是比液氢更环保的燃料 | B. |
| C.偏二甲基肼的燃烧热为2250kJ/mol | D.该反应是一个熵增的自发反应 |
(3)飞船在发射前,运载火箭要加注燃料,火箭的周围常常会看到淡淡的黄色烟雾。这是由于燃料推进时,需要减压排出部分
①已知和
的结构式分别是
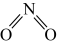 和
和 ,实验测得N-N的键能为167kJ/mol,
,实验测得N-N的键能为167kJ/mol,中氮氧键(
)的键能为466kJ/mol,
中氮氧键(
)的键能为438.5kJ/mol;
转化为
的
B.b点的操作是压缩注射器
C.c点与a点相比,
D.若不忽略体系温度变化,且没有能量损失,则b、c两点的平衡常数
③反应
④反应温度
北京时间2021年10月16日,搭载神舟十三号载人飞船的长征二号F遥十三运载火箭,在酒泉卫星发射中心发射成功。
(1)我国使用的推进器主要是以液体火箭推进器为主,推进器以液态偏二甲肼和四氧化二氮为主要燃料,其反应方程式为C2H8N2(l)+2N2O4(l) 3N2(g)+2CO2(g)+4H2O(g)。根据以下热化学方程式求出该热化学方程式的焓变△H=
3N2(g)+2CO2(g)+4H2O(g)。根据以下热化学方程式求出该热化学方程式的焓变△H=__ 。
①C2H8N2(l)+4O2(g)=2CO2(g)+N2(g)+4H2O(l) △H1=a kJ/mol
②N2(g)+O2(g)=2NO(g) △H2=b kJ/mol
③2NO(g)+O2(g)=N2O4(l) △H3=c kJ/mol
(2)因偏二甲肼和四氧化二氮有剧毒且价格昂贵,逐渐被其它燃料替代。如肼(N2H4)和强氧化剂过氧化氢(H2O2)反应产生大量N2和H2O,并放出大量热。已知:1.28 g液态肼与足量的液态过氧化氢反应,生成氮气和水蒸气,放出25.6 kJ的热量。
①写出该反应的热化学方程式:___________ 。
②此反应用于火箭推进的优点有______ 。(写出一条即可)
(3)液氧甲烷火箭发动机是介于液氧煤油和液氧液氢之间的一个选择,其燃烧的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(1) △H=-890.3 kJ•mol-1,根据以下信息,求算C=O的键能:__ 。
(1)我国使用的推进器主要是以液体火箭推进器为主,推进器以液态偏二甲肼和四氧化二氮为主要燃料,其反应方程式为C2H8N2(l)+2N2O4(l)
①C2H8N2(l)+4O2(g)=2CO2(g)+N2(g)+4H2O(l) △H1=a kJ/mol
②N2(g)+O2(g)=2NO(g) △H2=b kJ/mol
③2NO(g)+O2(g)=N2O4(l) △H3=c kJ/mol
(2)因偏二甲肼和四氧化二氮有剧毒且价格昂贵,逐渐被其它燃料替代。如肼(N2H4)和强氧化剂过氧化氢(H2O2)反应产生大量N2和H2O,并放出大量热。已知:1.28 g液态肼与足量的液态过氧化氢反应,生成氮气和水蒸气,放出25.6 kJ的热量。
①写出该反应的热化学方程式:
②此反应用于火箭推进的优点有
(3)液氧甲烷火箭发动机是介于液氧煤油和液氧液氢之间的一个选择,其燃烧的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(1) △H=-890.3 kJ•mol-1,根据以下信息,求算C=O的键能:
| 共价键 | C—H | O=O | H—O |
| 键能(kJ•mol-1) | 413 | 498 | 464 |
| 热化学方程式 | H2O(1)=H2O(g) △H=+44 kJ•mol-1 | ||
(1)已知下列反应:SO2(g)+2OH-(aq)=SO (aq)+H2O(l) ΔH1,ClO-(aq)+SO
(aq)+H2O(l) ΔH1,ClO-(aq)+SO (aq)=SO
(aq)=SO (aq)+Cl-(aq) ΔH2,CaSO4(s)=Ca2+(aq)+SO
(aq)+Cl-(aq) ΔH2,CaSO4(s)=Ca2+(aq)+SO (aq) ΔH3,则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)=CaSO4(s)+H2O(l)+Cl-(aq)的ΔH=
(aq) ΔH3,则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)=CaSO4(s)+H2O(l)+Cl-(aq)的ΔH=______________ 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)ΔH=+49.0kJ·mol-1②CH3OH(g)+ O2(g)=CO2(g)+2H2(g)ΔH=-192.9kJ·mol-1,又知③H2O(g)=H2O(l) ΔH=-44kJ·mol-1,则甲醇燃烧生成液态水的热化学方程式:
O2(g)=CO2(g)+2H2(g)ΔH=-192.9kJ·mol-1,又知③H2O(g)=H2O(l) ΔH=-44kJ·mol-1,则甲醇燃烧生成液态水的热化学方程式:_______ 。
(3)下表是部分化学键的键能数据,已知1mol白磷(P4)完全燃烧放热为dkJ,白磷及其完全燃烧的产物结构如图所示,则表中x=________ kJ·mol-1(用含有a、b、c、d的代数式表示)。

(4)①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)ΔH4=-1048.9kJ·mol-1,上述反应热效应之间的关系式为ΔH4=__________ ,联氨和N2O4可作为火箭推进剂的主要原因为_________ 。
(5)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:①CO(g)+2H2(g) CH3OH(g) ΔH1②CO2(g)+3H2(g)
CH3OH(g) ΔH1②CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2③CO2(g)+H2(g)
CH3OH(g)+H2O(g) ΔH2③CO2(g)+H2(g) CO(g)+H2O(g) ΔH3,已知反应①中相关的化学键键能数据如下:
CO(g)+H2O(g) ΔH3,已知反应①中相关的化学键键能数据如下:
由此计算ΔH1=____ kJ·mol-1;已知ΔH2=-58kJ·mol-1,则ΔH3=_____ kJ·mol-1。
(6)已知反应2HI(g)=H2(g)+I2(g)的ΔH=+11kJ·mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为____ kJ。
(7)碘可用作心脏起搏器电源——锂碘电池的材料。该电池反应为:2Li(s)+I2(s)=2LiI(s) ΔH,已知:4Li(s)+O2(g)=2Li2O(s) ΔH1,4LiI(s)+O2(g)=2I2(s)+2Li2O(s)ΔH2,则电池反应的ΔH=____________ 。
(8)25℃,101kPa下,①2Na(s)+ O2(g)=Na2O(s) ΔH1=-414kJ·mol-1
O2(g)=Na2O(s) ΔH1=-414kJ·mol-1
②2Na(s)+O2(g)=Na2O2(s)ΔH2=-511kJ·mol-1,则Na2O2(s)+2Na(s)=2Na2O(s)ΔH是_______ 。
(9)已知25℃时,①HF(aq)+OH-(aq)=F-(aq)+H2O(l)ΔH=-67.7kJ·mol-1②H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3kJ·mol-1,则氢氟酸的电离方程式及热效应可表示为:HF(aq) F-(aq)+H+(aq)ΔH=
F-(aq)+H+(aq)ΔH=________ kJ·mol-1。
(10)已知:温度过高时,WO2(s)转变为WO2(g):
①WO2(s)+2H2(g)=W(s)+2H2O(g)ΔH=+66.0kJ·mol-1②WO2(g)+2H2(g)=W(s)+2H2O(g)ΔH=-137.9kJ·mol-1,则WO2(s)=WO2(g)的ΔH=____________ 。
(11)已知:25℃、101 kPa时,Mn(s)+O2(g)=MnO2(s)ΔH=-520kJ·mol-1,S(s)+O2(g)=SO2(g) ΔH=-297kJ·mol-1,Mn(s)+S(s)+2O2(g)=MnSO4(s)ΔH=-1065kJ·mol-1,SO2与MnO2反应生成无水MnSO4的热化学方程式是________ 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)ΔH=+49.0kJ·mol-1②CH3OH(g)+
(3)下表是部分化学键的键能数据,已知1mol白磷(P4)完全燃烧放热为dkJ,白磷及其完全燃烧的产物结构如图所示,则表中x=

| 化学键 | P—P | P—O | O=O | P=O |
| 键能/(kJ·mol-1) | a | b | c | x |
(4)①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)ΔH4=-1048.9kJ·mol-1,上述反应热效应之间的关系式为ΔH4=
(5)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:①CO(g)+2H2(g)
| 化学键 | H—H | C—O | C≡O | H—O | C—H |
| E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算ΔH1=
(6)已知反应2HI(g)=H2(g)+I2(g)的ΔH=+11kJ·mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为
(7)碘可用作心脏起搏器电源——锂碘电池的材料。该电池反应为:2Li(s)+I2(s)=2LiI(s) ΔH,已知:4Li(s)+O2(g)=2Li2O(s) ΔH1,4LiI(s)+O2(g)=2I2(s)+2Li2O(s)ΔH2,则电池反应的ΔH=
(8)25℃,101kPa下,①2Na(s)+
②2Na(s)+O2(g)=Na2O2(s)ΔH2=-511kJ·mol-1,则Na2O2(s)+2Na(s)=2Na2O(s)ΔH是
(9)已知25℃时,①HF(aq)+OH-(aq)=F-(aq)+H2O(l)ΔH=-67.7kJ·mol-1②H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3kJ·mol-1,则氢氟酸的电离方程式及热效应可表示为:HF(aq)
(10)已知:温度过高时,WO2(s)转变为WO2(g):
①WO2(s)+2H2(g)=W(s)+2H2O(g)ΔH=+66.0kJ·mol-1②WO2(g)+2H2(g)=W(s)+2H2O(g)ΔH=-137.9kJ·mol-1,则WO2(s)=WO2(g)的ΔH=
(11)已知:25℃、101 kPa时,Mn(s)+O2(g)=MnO2(s)ΔH=-520kJ·mol-1,S(s)+O2(g)=SO2(g) ΔH=-297kJ·mol-1,Mn(s)+S(s)+2O2(g)=MnSO4(s)ΔH=-1065kJ·mol-1,SO2与MnO2反应生成无水MnSO4的热化学方程式是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


