解答题-实验探究题 适中0.65 引用1 组卷227
苯胺(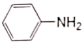 )是重要的化工原料,其制备原理为:2
)是重要的化工原料,其制备原理为:2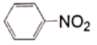 +3Sn+12HCl
+3Sn+12HCl 2
2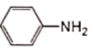 +3SnCl4+4 H2O
+3SnCl4+4 H2O
已知:苯胺类似氨气有碱性,与盐酸反应生成可溶于水的盐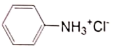 ;部分物质物理性质见下表:
;部分物质物理性质见下表:
回答下列问题:
(1)实验室用苯制取硝基苯的化学方程式为___________ 。
(2)往硝基苯中加入 和足量盐酸充分还原,冷却后,往混合物中加入过量
和足量盐酸充分还原,冷却后,往混合物中加入过量 溶液得碱化液,加
溶液得碱化液,加 溶液的主要目的是析出苯胺,反应的离子方程式为
溶液的主要目的是析出苯胺,反应的离子方程式为___________ 。
(3)分离提纯:
步骤ⅰ.将碱化液蒸馏,收集到苯胺与水的混合物,分液得粗苯胺和水溶液;
步骤ⅱ.步骤ⅰ所得水溶液中加 至饱和,用乙醚萃取得萃取液与粗苯胺合并:
至饱和,用乙醚萃取得萃取液与粗苯胺合并:
步骤ⅲ。合并溶液用干燥剂干燥,过滤,将滤液蒸馏并收集温度 时的馏分得到苯胺。
时的馏分得到苯胺。
①步骤ⅰ蒸馏不需温度计控制温度,试依据收集馏分的特点,分析原因是___________ 。
②步骤ⅱ萃取分液操作过程中要远离明火及热源,原因是___________ 。如果没有步骤ⅱ,苯胺的产率___________ (填“不变”、“增大”或“减小”)。步骤ⅲ中干燥剂可以选用___________ (填序号)
a.浓硫酸 b.五氧化二磷 c. 固体
固体
③步骤ⅲ中蒸馏获得苯胺的温度 的范围为
的范围为___________ 。
(4)二次纯化:
苯胺中混有少量硝基苯杂质,可以采用如下方案除杂提纯:
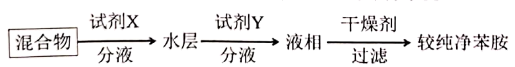
试剂 是
是___________ ,试剂 是
是___________ ,“液相”是___________ (填“水层”或“有机层”)
 )是重要的化工原料,其制备原理为:2
)是重要的化工原料,其制备原理为:2 +3Sn+12HCl
+3Sn+12HCl +3SnCl4+4 H2O
+3SnCl4+4 H2O已知:苯胺类似氨气有碱性,与盐酸反应生成可溶于水的盐
 ;部分物质物理性质见下表:
;部分物质物理性质见下表:| 物质 | 熔点/℃ | 沸点/℃ | 溶解性 | 密度/ |
| 苯胺 | 184 | 微溶于水,易溶于乙醚 | 1.02 | |
| 硝基苯 | 5.7 | 210.9 | 难溶于水,易溶于乙醚 | 1.23 |
| 乙醚 | 34.6 | 微溶于水 | 0.7134 |
(1)实验室用苯制取硝基苯的化学方程式为
(2)往硝基苯中加入
(3)分离提纯:
步骤ⅰ.将碱化液蒸馏,收集到苯胺与水的混合物,分液得粗苯胺和水溶液;
步骤ⅱ.步骤ⅰ所得水溶液中加
步骤ⅲ。合并溶液用干燥剂干燥,过滤,将滤液蒸馏并收集温度
①步骤ⅰ蒸馏不需温度计控制温度,试依据收集馏分的特点,分析原因是
②步骤ⅱ萃取分液操作过程中要远离明火及热源,原因是
a.浓硫酸 b.五氧化二磷 c.
③步骤ⅲ中蒸馏获得苯胺的温度
(4)二次纯化:
苯胺中混有少量硝基苯杂质,可以采用如下方案除杂提纯:

试剂
20-21高二下·广东佛山·期末
类题推荐
苯胺(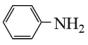 )是重要的化工原料,其制备原理为:
)是重要的化工原料,其制备原理为:
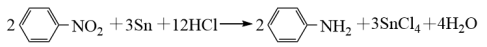
已知:苯胺类似氨气有碱性,与盐酸反应生成可溶于水的盐 。
。
乙醚为极易挥发的液体,是用途广泛的有机溶剂,与空气接触会形成易爆混合物。部分物质物理性质见表:
回答下列问题:
(1)实验室用苯制取硝基苯的化学方程式为_______ 。
(2)图甲中 装置的名称为
装置的名称为_______ ,往硝基苯中加入 和足量盐酸充分还原生成盐,冷却后,往混合物中加入过量
和足量盐酸充分还原生成盐,冷却后,往混合物中加入过量 溶液得碱化液。加
溶液得碱化液。加 溶液的主要目的是析出苯胺,反应的离子方程式为
溶液的主要目的是析出苯胺,反应的离子方程式为_______ 。
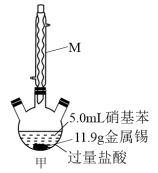
(3)分离提纯:
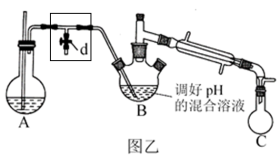
步骤i.如图乙,加热装置 产生水蒸气,采用水蒸气蒸馏的方法,用
产生水蒸气,采用水蒸气蒸馏的方法,用热的水蒸气 将 中的苯胺逐渐吹出至
中的苯胺逐渐吹出至 中(收集到苯胺及水的混合液体),从混合物中分离出粗苯胺及水溶液。
中(收集到苯胺及水的混合液体),从混合物中分离出粗苯胺及水溶液。
步骤ⅱ.步骤i所得水溶液中加 至饱和,用乙醚萃取得萃取液与粗苯胺合并。
至饱和,用乙醚萃取得萃取液与粗苯胺合并。
步骤ⅲ.合并溶液用干燥剂干燥,过滤,将滤液蒸馏并收集温度T时的馏分得到苯胺 。
。
①图乙中T型管 处方框区域玻璃导管不宜过长,原因是
处方框区域玻璃导管不宜过长,原因是_______ 。
②步骤ⅱ萃取分液操作过程中要远离明火及热源,原因是_______ 。步骤ⅲ中干燥剂可以选用_______ (填序号)
a.浓硫酸 b.五氧化二磷 c.碱石灰
③步骤ⅲ中蒸馏获得苯胺需控制温度为_______ 左右。
④该实验中所得苯胺的产率为_______ (保留三位有效数字)。
 )是重要的化工原料,其制备原理为:
)是重要的化工原料,其制备原理为: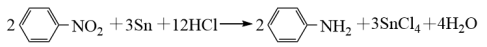
已知:苯胺类似氨气有碱性,与盐酸反应生成可溶于水的盐
 。
。乙醚为极易挥发的液体,是用途广泛的有机溶剂,与空气接触会形成易爆混合物。部分物质物理性质见表:
| 物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 溶解性 | 密度 |
| 苯胺 | 微溶于水,易溶于乙醚 | ||||
| 硝基苯 | 难溶于水,易溶于乙醚 | ||||
| 乙醚 | 微溶于水 |
(1)实验室用苯制取硝基苯的化学方程式为
(2)图甲中

(3)分离提纯:

步骤i.如图乙,加热装置
步骤ⅱ.步骤i所得水溶液中加
步骤ⅲ.合并溶液用干燥剂干燥,过滤,将滤液蒸馏并收集温度T时的馏分得到苯胺
①图乙中T型管
②步骤ⅱ萃取分液操作过程中要远离明火及热源,原因是
a.浓硫酸 b.五氧化二磷 c.碱石灰
③步骤ⅲ中蒸馏获得苯胺需控制温度为
④该实验中所得苯胺的产率为
苯胺(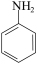 )是重要的化工原料。某兴趣小组在实验室里进行苯胺的相关实验。
)是重要的化工原料。某兴趣小组在实验室里进行苯胺的相关实验。
已知:①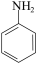 和 NH3相似,与盐酸反应生成易溶于水的盐
和 NH3相似,与盐酸反应生成易溶于水的盐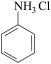
②用硝基苯制取苯胺的反应原理:2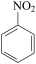 +3Sn+12HCl→2
+3Sn+12HCl→2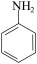 +3SnCl4+4H2O
+3SnCl4+4H2O
③有关物质的部分物理性质见表:
Ⅰ.比较苯胺与氨气的性质
(1)将分别蘸有浓氨水和浓盐酸的玻璃棒靠近,产生白烟,反应的化学方程式为__________ ;用苯胺代替浓氨水重复上述实验,却观察不到白烟,原因是______ 。
Ⅱ.制备苯胺。往图所示装置(夹持装置略,下同)的冷凝管口分批加入 20mL 浓盐酸(过量),置于热水浴中回流 20min,使硝基苯充分还原;冷却后,往三颈烧瓶中滴入一定量 50% NaOH 溶液,至溶液呈碱性。
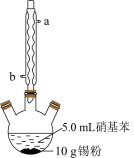
(2)冷凝管的进水口是____ (填“a”或“b”);
(3)滴加 NaOH 溶液的主要目的是析出苯胺,反应的离子方程式为______________ 。
Ⅲ.提取苯胺。
i.取出上图所示装置中的三颈烧瓶,改装为如图所示装置:
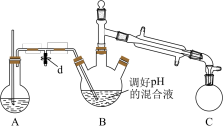
ii.加热装置 A 产生水蒸气,烧瓶 C 中收集到苯胺与水的混合物;分离混合物得到粗苯胺和水溶液。
ii.往所得水溶液加入氯化钠固体,使溶液达到饱和状态,再用乙醚萃取,得到乙醚萃取液。
iii.合并粗苯胺和乙醚萃取液,用 NaOH 固体干燥,蒸馏后得到苯胺 2.79g。
(4)装置B无需用到温度计,理由是______ 。
(5)操作i中,为了分离混合物,取出烧瓶C前,应先打开止水夹d,再停止加热,理由是__________ 。
(6)该实验中苯胺的产率为_____________ 。
(7)欲在不加热条件下除去苯胺中的少量硝基苯杂质,简述实验方案:_________________ 。
 )是重要的化工原料。某兴趣小组在实验室里进行苯胺的相关实验。
)是重要的化工原料。某兴趣小组在实验室里进行苯胺的相关实验。已知:①
 和 NH3相似,与盐酸反应生成易溶于水的盐
和 NH3相似,与盐酸反应生成易溶于水的盐
②用硝基苯制取苯胺的反应原理:2
 +3Sn+12HCl→2
+3Sn+12HCl→2 +3SnCl4+4H2O
+3SnCl4+4H2O③有关物质的部分物理性质见表:
| 物质 | 熔点/℃ | 沸点/℃ | 溶解性 | 密度/g∙cm-3 |
| 苯胺 | -6.3 | 184 | 微溶于水,易溶于乙醚 | 1.02 |
| 硝基苯 | 5.7 | 210.9 | 难溶于水,易溶于乙醚 | 1.23 |
| 乙醚 | -116.2 | 34.6 | 微溶于水 | 0.7134 |
Ⅰ.比较苯胺与氨气的性质
(1)将分别蘸有浓氨水和浓盐酸的玻璃棒靠近,产生白烟,反应的化学方程式为
Ⅱ.制备苯胺。往图所示装置(夹持装置略,下同)的冷凝管口分批加入 20mL 浓盐酸(过量),置于热水浴中回流 20min,使硝基苯充分还原;冷却后,往三颈烧瓶中滴入一定量 50% NaOH 溶液,至溶液呈碱性。

(2)冷凝管的进水口是
(3)滴加 NaOH 溶液的主要目的是析出苯胺,反应的离子方程式为
Ⅲ.提取苯胺。
i.取出上图所示装置中的三颈烧瓶,改装为如图所示装置:

ii.加热装置 A 产生水蒸气,烧瓶 C 中收集到苯胺与水的混合物;分离混合物得到粗苯胺和水溶液。
ii.往所得水溶液加入氯化钠固体,使溶液达到饱和状态,再用乙醚萃取,得到乙醚萃取液。
iii.合并粗苯胺和乙醚萃取液,用 NaOH 固体干燥,蒸馏后得到苯胺 2.79g。
(4)装置B无需用到温度计,理由是
(5)操作i中,为了分离混合物,取出烧瓶C前,应先打开止水夹d,再停止加热,理由是
(6)该实验中苯胺的产率为
(7)欲在不加热条件下除去苯胺中的少量硝基苯杂质,简述实验方案:
苯胺(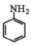 )是重要的化工原料。某兴趣小组在实验室里进行苯胺的相关实验。已知:
)是重要的化工原料。某兴趣小组在实验室里进行苯胺的相关实验。已知:
①和NH3相似,与盐酸反应生成易溶于水的盐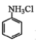
②用硝基苯制取苯胺的反应原理:2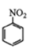 +3Sn+12HCl 2
+3Sn+12HCl 2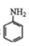 +3SnCl4+4H2O
+3SnCl4+4H2O
③有关物质的部分物理性质见下表:
I.比较苯胺与氨气的性质
(1)将分别蘸有浓氨水和浓盐酸的玻璃棒靠近,产生白烟。用苯胺代替浓氨水重复上述实验,却观察不到白烟,原因是___________ 。
Ⅱ.制备苯胺
往图1所示装置(夹持装置略,下同)的冷凝管口分批加入20mL浓盐酸(过量),置于热水浴中回流20min,使硝基苯充分还原;冷却后,往三颈烧瓶中滴入一定量50% NaOH溶液,至溶液呈碱性。
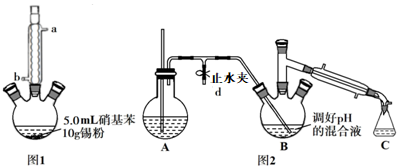
(2)图1中冷凝管的进水口是___________ (填“a”或“b”)。
(3)滴加NaOH溶液的主要目的是析出苯胺,反应的离子方程式为___________ 。
Ⅲ.提取苯胺
i.取图1所示装置中的三颈烧瓶,改装为如图2所示的装置进行汽提,加热装置省略。装置A用来产生水蒸气,锥形瓶C用来收集苯胺与水的混合物,分离混合物得到粗苯胺和水溶液。
ii.向所得水溶液中加入氯化钠固体,使溶液达到饱和状态,再用乙醚萃取,得到乙醚萃取液。
iii.合并粗苯胺和乙醚萃取液,用NaOH固体干燥,蒸馏后得到苯胺2.79g。
(4)装置B无需用到温度计,理由是___________ 。
(5)操作i中,在蒸馏完毕后,为了防止B中液体倒吸,合理的操作是___________ 。该实验中苯胺的产率为___________ 。
(6)请简述在不加热条件下除去苯胺中的少量硝基苯杂质的实验方案:___________ 。
 )是重要的化工原料。某兴趣小组在实验室里进行苯胺的相关实验。已知:
)是重要的化工原料。某兴趣小组在实验室里进行苯胺的相关实验。已知:①和NH3相似,与盐酸反应生成易溶于水的盐

②用硝基苯制取苯胺的反应原理:2
 +3Sn+12HCl 2
+3Sn+12HCl 2 +3SnCl4+4H2O
+3SnCl4+4H2O③有关物质的部分物理性质见下表:
| 物质 | 熔点/℃ | 沸点/℃ | 溶解性 | 密度/ g.cm-3 |
| 苯胺 | -6.3 | 184 | 微溶于水,易溶于乙醚 | 1. 02 |
| 硝基苯 | 5.7 | 210. 9. | 难溶于水,易溶于乙醚 | 1.23 |
| 乙醚 | -116.2 | 34.6 | 微溶于水 | 0.7134 |
(1)将分别蘸有浓氨水和浓盐酸的玻璃棒靠近,产生白烟。用苯胺代替浓氨水重复上述实验,却观察不到白烟,原因是
Ⅱ.制备苯胺
往图1所示装置(夹持装置略,下同)的冷凝管口分批加入20mL浓盐酸(过量),置于热水浴中回流20min,使硝基苯充分还原;冷却后,往三颈烧瓶中滴入一定量50% NaOH溶液,至溶液呈碱性。

(2)图1中冷凝管的进水口是
(3)滴加NaOH溶液的主要目的是析出苯胺,反应的离子方程式为
Ⅲ.提取苯胺
i.取图1所示装置中的三颈烧瓶,改装为如图2所示的装置进行汽提,加热装置省略。装置A用来产生水蒸气,锥形瓶C用来收集苯胺与水的混合物,分离混合物得到粗苯胺和水溶液。
ii.向所得水溶液中加入氯化钠固体,使溶液达到饱和状态,再用乙醚萃取,得到乙醚萃取液。
iii.合并粗苯胺和乙醚萃取液,用NaOH固体干燥,蒸馏后得到苯胺2.79g。
(4)装置B无需用到温度计,理由是
(5)操作i中,在蒸馏完毕后,为了防止B中液体倒吸,合理的操作是
(6)请简述在不加热条件下除去苯胺中的少量硝基苯杂质的实验方案:
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


