填空题 0.65 引用1 组卷25
过渡金属大环配合物可以用作模拟金属酶的活性中心,其中Cu(I)配合物因可活化O2等小分子而倍受关注。最近有人在空气中以间苯二甲醛和三(3-氨丙基)胺(缩写为trpn)在Ag+离子存在下通过胺醛缩合生成Ag(I)席夫碱大环配合物1,并对其中氧原子的来源进行了研究,相关合成路线如下(图中未标出银的配位键):

(1)将纯化所得产物做了元素分析和红外光谱等基本表征,化合物的官能团在红外光谱上产生不同的特征吸收峰,如何利用配合物1的红外光谱判断产物中不含原料及低分子量的线性聚合物类的副产物____ ?
(2)在氩气氛中得到了配合物3,将配合物1和3在氩气氛中用足量的NaBH4还原,得到化合物4和5,并进行了红外光谱研究。请推测化合物4和5红外光谱上最主要的差别是______ ?
(3)测定了配合物1和3的晶体结构,结果发现配合物3中无氧,配合物1中和O原子相连的C原子的相关结构数据为:C-O键长为150.0pm、C-N键长为124.7pm,N-C-O、C-C-O和N-C-C的键角分别为126.0°,112.5°和121.5°,如何利用这些数据说明在空气中得到的确实是配合物1,而不是由于H2O分子在C=N双键上的加成所得到的配合物2______ ?
(4)在盐酸存在下将配合物1和3水解,过滤,滤液经分离除去trpn后的剩余组分经高效液相色谱分析,配合物1的水解产物色谱图上显示有A和B两个组分,代表纯组分相对量的峰面积比为33.02:66.09(A:B),而配合物3的水解产物仅有一种组分C.对A和B进行了质谱表征,其电喷雾质谱图分别为(a)和(b)(质谱图的纵坐标为相对丰度,横坐标为质荷比,相对丰度100%的峰对应的质荷比为M+1)。
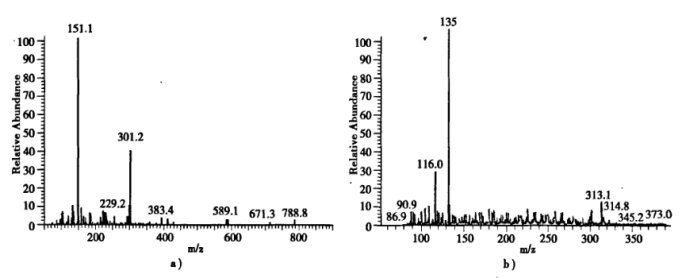
说明A、B和C各为何物:A____ 、B____ 、C_____ 。
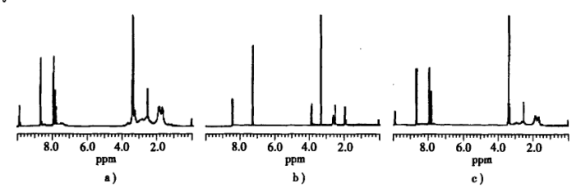
(5)在无trpn,其他条件和合成配合物1相同时,AgNO3在空气中不能氧化间苯二甲醛。对配合物进行氢核磁共振实验,所得谱图如下(图中不同位置的信号表示氢的化学环境不同),其中(a)图对应配合物1,(b)图对应无氧条件下新鲜制备的配合物3,(c)图对应配合物3在空气中放置-周后所得样品。结合前面几步的实验能否判断配合物1中氧原子的来源_________ ?请简述理由___________ 。

(1)将纯化所得产物做了元素分析和红外光谱等基本表征,化合物的官能团在红外光谱上产生不同的特征吸收峰,如何利用配合物1的红外光谱判断产物中不含原料及低分子量的线性聚合物类的副产物
(2)在氩气氛中得到了配合物3,将配合物1和3在氩气氛中用足量的NaBH4还原,得到化合物4和5,并进行了红外光谱研究。请推测化合物4和5红外光谱上最主要的差别是
(3)测定了配合物1和3的晶体结构,结果发现配合物3中无氧,配合物1中和O原子相连的C原子的相关结构数据为:C-O键长为150.0pm、C-N键长为124.7pm,N-C-O、C-C-O和N-C-C的键角分别为126.0°,112.5°和121.5°,如何利用这些数据说明在空气中得到的确实是配合物1,而不是由于H2O分子在C=N双键上的加成所得到的配合物2
(4)在盐酸存在下将配合物1和3水解,过滤,滤液经分离除去trpn后的剩余组分经高效液相色谱分析,配合物1的水解产物色谱图上显示有A和B两个组分,代表纯组分相对量的峰面积比为33.02:66.09(A:B),而配合物3的水解产物仅有一种组分C.对A和B进行了质谱表征,其电喷雾质谱图分别为(a)和(b)(质谱图的纵坐标为相对丰度,横坐标为质荷比,相对丰度100%的峰对应的质荷比为M+1)。

说明A、B和C各为何物:A
(5)在无trpn,其他条件和合成配合物1相同时,AgNO3在空气中不能氧化间苯二甲醛。对配合物进行氢核磁共振实验,所得谱图如下(图中不同位置的信号表示氢的化学环境不同),其中(a)图对应配合物1,(b)图对应无氧条件下新鲜制备的配合物3,(c)图对应配合物3在空气中放置-周后所得样品。结合前面几步的实验能否判断配合物1中氧原子的来源

2008高三上·全国·竞赛


