解答题-原理综合题 较难0.4 引用1 组卷167
选择性催化还原法(SCR)是目前应用最为广泛的氮氧化物NOx的净化方法,其原理是利用NH3在特定催化剂作用下将NOx还原为N2。
主反应:4NH3(g) +4NO(g)+O2(g) 4N2(g)+6H2O(g) ΔH1
4N2(g)+6H2O(g) ΔH1
副反应:4NH3(g)+ 3O2(g) 2N2(g)+6H2O(g) ΔH2
2N2(g)+6H2O(g) ΔH2
(1)在无氧条件下,NH3也可还原NO:4NH3(g)+6NO(g) 5N2(g)+6H2O(g) ΔH3,
5N2(g)+6H2O(g) ΔH3,
则ΔH2=___________ (用含ΔH1、ΔH3的式子表示)。一定温度下,向2 L密闭刚性容器(含催化剂)中投入2 mol NH3和3 mol NO,发生反应4NH3(g)+6NO(g)  5N2(g)+ 6H2O(g)。达到平衡状态时,NO的转化率为60 %,则平衡常数为
5N2(g)+ 6H2O(g)。达到平衡状态时,NO的转化率为60 %,则平衡常数为___________ mol·L-1(列出计算式即可)。
(2)目前使用的SCR催化剂是V2O5-WO3/TiO2,关于该催化剂的说法正确的是___________ 。
A.能加快反应速率,并且改变反应的焓变
B.能增大NH3还原NOx反应的平衡常数
C.具有选择性,能降低特定反应的活化能
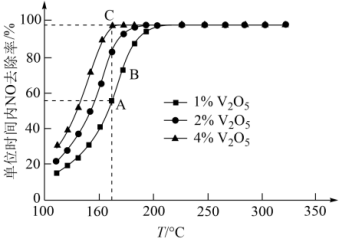
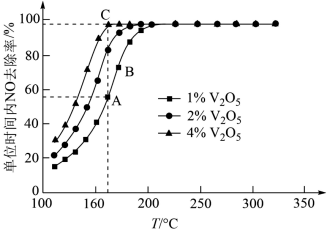
(3)催化剂V2O5-WO3/TiO2中的V2O5是活性组分。在石英微型反应器中以一定流速通过烟气[n(O2):n(NH3):n(NO)=71:1:1],在不同温度下进行该催化还原反应,V2O5的质量分数对单位时间内NO去除率的影响如图所示。
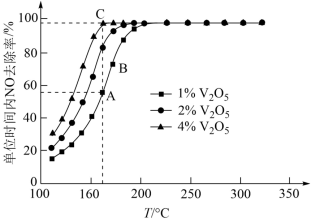
①从起始至对应A、B、C三点的平均反应速率由大到小的顺序为___________ 。
②V2O5的质量分数对该催化剂活性的影响是___________ 。
(4)NO2存在如下平衡:2NO2(g) N2O4(g) △H<0,在一定条件下,NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)= k2·p(N2O4)。一定温度下,k1、k2与平衡常数kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系k1=
N2O4(g) △H<0,在一定条件下,NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)= k2·p(N2O4)。一定温度下,k1、k2与平衡常数kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系k1=_____ 。
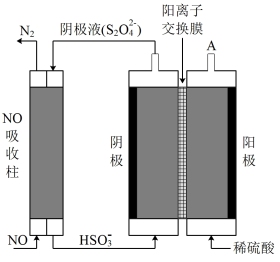
(5)还可用间接电解法除NO。其原理如图所示,则电解池阴极的电极反应为___________ 。
主反应:4NH3(g) +4NO(g)+O2(g)
副反应:4NH3(g)+ 3O2(g)
(1)在无氧条件下,NH3也可还原NO:4NH3(g)+6NO(g)
则ΔH2=
(2)目前使用的SCR催化剂是V2O5-WO3/TiO2,关于该催化剂的说法正确的是
A.能加快反应速率,并且改变反应的焓变
B.能增大NH3还原NOx反应的平衡常数
C.具有选择性,能降低特定反应的活化能
(3)催化剂V2O5-WO3/TiO2中的V2O5是活性组分。在石英微型反应器中以一定流速通过烟气[n(O2):n(NH3):n(NO)=71:1:1],在不同温度下进行该催化还原反应,V2O5的质量分数对单位时间内NO去除率的影响如图所示。

①从起始至对应A、B、C三点的平均反应速率由大到小的顺序为
②V2O5的质量分数对该催化剂活性的影响是
(4)NO2存在如下平衡:2NO2(g)
(5)还可用间接电解法除NO。其原理如图所示,则电解池阴极的电极反应为

20-21高一下·黑龙江大庆·期末
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 、
、 、
、 、
、 分别表示
分别表示 、
、 、
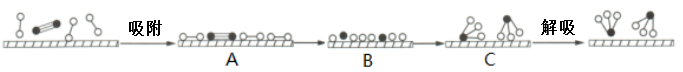
、 和催化剂,则在催化剂表面合成氨的过程如图所示:
和催化剂,则在催化剂表面合成氨的过程如图所示: