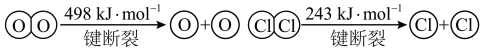解答题-原理综合题 适中0.65 引用1 组卷64
i.研究CO2的利用具有现实意义,比如将CO2与焦炭作用生成CO,CO可用于炼铁、设计燃料电池等。
已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1=+489kJ/mol
C(石墨)+CO2(g)=2CO(g) ΔH2=+172kJ/mol
写出Fe2O3和CO为原料冶炼铁的热化学方程式_______ 。
ii.环境空气质量指数(AQI)日报和实时报告包括了NO2、CO、O3、PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。请回答下列问题:
(1)汽车排出的尾气中含有CO和NO等气体,用化学方程式解释产生NO的原因:_______ 。
(2)汽车排气管内安装催化转化器,可使汽车尾气中的主要污染物转化为无毒的大气循环物质。已知:
N2(g)+O2(g)=2NO(g) ΔΗ=+180.5kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔΗ=-221.0kJ·mol-1
C(s)+O2(g)=CO2(g) ΔΗ=-393.5kJ·mol-1
则反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g)的ΔΗ=_______ kJ·mol-1。
iii.据报道,最近摩托罗拉公司研制了一种由甲醇和氧气以及强碱作电解质溶液的新型手机电池,电量可达现用镍氢电池或锂电池的10倍。已知该电池的总反应为 。请回答下列问题:
。请回答下列问题:
(1)该燃料电池的正极反应式为_______ 。
(2)该燃料电池的负极反应式为_______ 。
(3)当外电路中通过1.2mol电子时,理论上消耗甲醇的质量是_______ g。
已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1=+489kJ/mol
C(石墨)+CO2(g)=2CO(g) ΔH2=+172kJ/mol
写出Fe2O3和CO为原料冶炼铁的热化学方程式
ii.环境空气质量指数(AQI)日报和实时报告包括了NO2、CO、O3、PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。请回答下列问题:
(1)汽车排出的尾气中含有CO和NO等气体,用化学方程式解释产生NO的原因:
(2)汽车排气管内安装催化转化器,可使汽车尾气中的主要污染物转化为无毒的大气循环物质。已知:
N2(g)+O2(g)=2NO(g) ΔΗ=+180.5kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔΗ=-221.0kJ·mol-1
C(s)+O2(g)=CO2(g) ΔΗ=-393.5kJ·mol-1
则反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g)的ΔΗ=
iii.据报道,最近摩托罗拉公司研制了一种由甲醇和氧气以及强碱作电解质溶液的新型手机电池,电量可达现用镍氢电池或锂电池的10倍。已知该电池的总反应为
(1)该燃料电池的正极反应式为
(2)该燃料电池的负极反应式为
(3)当外电路中通过1.2mol电子时,理论上消耗甲醇的质量是
20-21高一下·四川宜宾·阶段练习
类题推荐
回答下列问题
(1)已知:
则2H2(g)+O2(g) =2H2O(g) ΔH=___________ kJ·mol-1。
(2)消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:

①N2(g)+O2(g) =2NO(g) ΔH1=___________
②2CO(g)+O2(g) = 2CO2(g) ΔH2=-565 kJ·mol-1
在催化剂作用下NO和CO转化为无毒气体,写出反应的热化学方程式:___________ 。
(3)CO和H2是工业上最常用的合成气,该合成气的制备方法很多,它们也能合成许多重要的有机物。制备该合成气的一种方法是以CH4和H2O为原料,有关反应的能量变化如图所示。
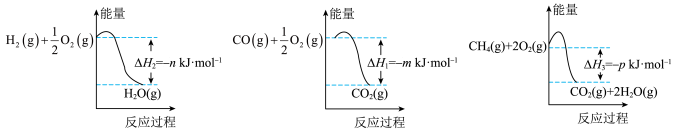
CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为___________ 。
(4)下图是锌锰干电池基本构造图,
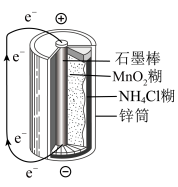
该电池的负极材料是___________ ,工作时NH 在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是
在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是___________ ;电路中每通过0.2 mol e-,负极质量减少___________ 。
(1)已知:
| 化学键 | H-H | O=O | O-H |
| 键能(kJ·mol-1) | 436 | 496 | 463 |
(2)消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:

①N2(g)+O2(g) =2NO(g) ΔH1=
②2CO(g)+O2(g) = 2CO2(g) ΔH2=-565 kJ·mol-1
在催化剂作用下NO和CO转化为无毒气体,写出反应的热化学方程式:
(3)CO和H2是工业上最常用的合成气,该合成气的制备方法很多,它们也能合成许多重要的有机物。制备该合成气的一种方法是以CH4和H2O为原料,有关反应的能量变化如图所示。

CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为
(4)下图是锌锰干电池基本构造图,

该电池的负极材料是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 O2(g)===CO2(g)+2H2(g) ΔH=-a kJ/mol,则a
O2(g)===CO2(g)+2H2(g) ΔH=-a kJ/mol,则a