解答题-原理综合题 较难0.4 引用1 组卷167
Ⅰ.二甲醚又称甲醚,简称DME,结构简式为 ,是一种无色气体,被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,在医药、燃料、农药工业中有许多独特的用途。
,是一种无色气体,被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,在医药、燃料、农药工业中有许多独特的用途。
(1)







由H2和CO直接制备二甲酵(另一产物为水蒸气)的热化学方程式为___________
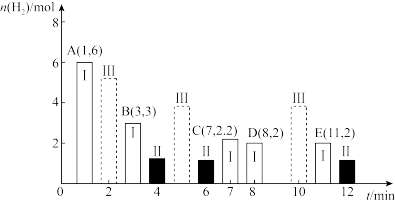
(2)T℃时,在2L密闭容器中充入4molCO和8molH2发生制备二甲醚的反应:
 (没有配平),测得环的物质的量随时间的变化情况如图中状态Ⅰ所示。
(没有配平),测得环的物质的量随时间的变化情况如图中状态Ⅰ所示。
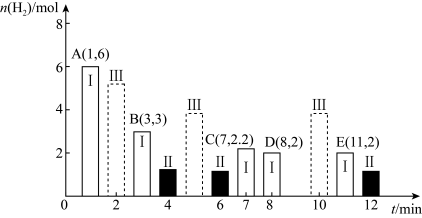
①T℃时,反应的平衡常数K1=___________ 。
②若仅改变某一条件,测得B的物质的最随时间的变化情况如图中状态Ⅱ所示,则K1___________ K2(填“>”、“<”或“=”)。
③若仅改变某一条件,测得B的物质的量随时间的变化情况如图中状态Ⅲ所示,则改变的条件可能是___________ 。
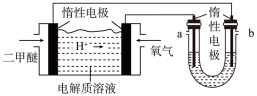
(3)燃料电池是一种绿色环保、高效的化学电源。二甲醚还可作燃料电池的燃料,以熔融 作为电解质,一极充入二甲醚,另一极充入空气和
作为电解质,一极充入二甲醚,另一极充入空气和 气体,该电池的负极反应式为
气体,该电池的负极反应式为___________ 。用该二甲醚燃料电池电解300mL饱和食盐水。电解一段时间后,当溶液的pH值为13(室温下测定)时,消耗二甲醛的质量为___________ g.(忽略溶液体积变化,不考虑损耗)
Ⅱ.25℃时,部分物质的电离平衡常数如表所示:
请回答下列问题:
(1)25℃时,0.1mol/L的 溶液呈
溶液呈___________ (填“酸性”、“碱性”或“中性”)
(2)用足量 溶液吸收工业尾气中少量SO2气体,发生反应的离子方程式为
溶液吸收工业尾气中少量SO2气体,发生反应的离子方程式为___________ 。
(3)25℃时,取浓度均为0.1000mol/L的醋酸溶液和氨水溶液各20.00mL,分别用0.1000mol/LNaOH溶液、0.1000mol/L盐酸进行中和滴定,滴定过程中溶液pH随滴加溶液的体积变化关系如图所示。下列说法错误的是_____________
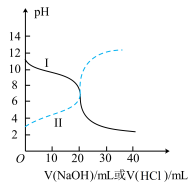
a.曲线Ⅰ,滴加溶液到10mL时:
b.当NaOH溶液和盐酸滴加至20.00mL时,曲线Ⅰ和Ⅱ刚好相交
c.曲线Ⅱ:滴加溶液到10.00mL时,溶液中
d.在逐滴加入NaOH溶液或盐酸至40.00mL的过程中,水的电离程度先增大后减小
(1)
由H2和CO直接制备二甲酵(另一产物为水蒸气)的热化学方程式为
(2)T℃时,在2L密闭容器中充入4molCO和8molH2发生制备二甲醚的反应:

①T℃时,反应的平衡常数K1=
②若仅改变某一条件,测得B的物质的最随时间的变化情况如图中状态Ⅱ所示,则K1
③若仅改变某一条件,测得B的物质的量随时间的变化情况如图中状态Ⅲ所示,则改变的条件可能是
(3)燃料电池是一种绿色环保、高效的化学电源。二甲醚还可作燃料电池的燃料,以熔融
Ⅱ.25℃时,部分物质的电离平衡常数如表所示:
| 化学式 | |||||
| 电离平衡常数 |
(1)25℃时,0.1mol/L的
(2)用足量
(3)25℃时,取浓度均为0.1000mol/L的醋酸溶液和氨水溶液各20.00mL,分别用0.1000mol/LNaOH溶液、0.1000mol/L盐酸进行中和滴定,滴定过程中溶液pH随滴加溶液的体积变化关系如图所示。下列说法错误的是

a.曲线Ⅰ,滴加溶液到10mL时:
b.当NaOH溶液和盐酸滴加至20.00mL时,曲线Ⅰ和Ⅱ刚好相交
c.曲线Ⅱ:滴加溶液到10.00mL时,溶液中
d.在逐滴加入NaOH溶液或盐酸至40.00mL的过程中,水的电离程度先增大后减小
20-21高二下·湖北·期末
类题推荐
Ⅰ、①纯碱为工业和生活中常用的原料,其水溶液呈弱碱性,原因为存在化学平衡:_____________ ,(用离子方程式表达)其平衡常数 K 的表达式为:_____________ 。
②已知室温下,碳酸的电离常数K1=4.4×10-7,K2=4.7×10-11。NaHCO3水溶液显碱性,原因:_____________ (用K 定量解释)。
③在NaHCO3溶液中继续逐渐通入二氧化碳,至溶液中n(HCO3-):n(H2CO3)=_____________ 时溶液可以达中性。
Ⅱ、工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g) CH3OH(g) ΔH (CO结构式为C≡O)。又知某些化学键的键能(断开 1 mol化学键时所需要的最低能量)数值如下表:
CH3OH(g) ΔH (CO结构式为C≡O)。又知某些化学键的键能(断开 1 mol化学键时所需要的最低能量)数值如下表:

则ΔH =_____________ ,在相应的反应条件下,将 1 mol CO(g)与足量H2混合充分反应后,放出或吸收的热量与ΔH 的数值相对大小关系是________ 。
Ⅲ、电化学降解NO3-的原理如下图所示。
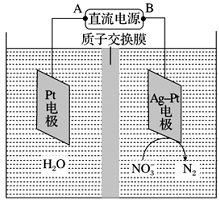
①电源 A 极为________ (填“正极”或“负极”),阴极反应式为________________ 。
②若电解过程中转移了 1 mol 电子,则膜左侧电解液的质量减少量为________ g。
Ⅳ、已知NO2和N2O4可以相互转化:2NO2(g) N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为 2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如下图。
N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为 2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如下图。
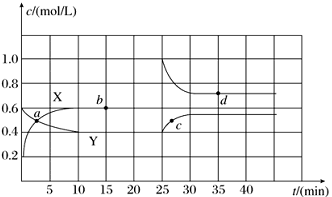
①图中共有两条曲线X和Y,其中曲线________ 表示NO2浓度随时间的变化。下列不能说明该反应已达到平衡状态的是________ 。
②前 10 min内用NO2表示的化学反应速率v(NO2)=________ mol/(L·min)。
③反应 25 min 时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是_____________ (用文字表达);其平衡常数 K(d)________ K(b)(填“>”、“=”或“<”)。
②已知室温下,碳酸的电离常数K1=4.4×10-7,K2=4.7×10-11。NaHCO3水溶液显碱性,原因:
③在NaHCO3溶液中继续逐渐通入二氧化碳,至溶液中n(HCO3-):n(H2CO3)=
Ⅱ、工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)

则ΔH =
Ⅲ、电化学降解NO3-的原理如下图所示。

①电源 A 极为
②若电解过程中转移了 1 mol 电子,则膜左侧电解液的质量减少量为
Ⅳ、已知NO2和N2O4可以相互转化:2NO2(g)

①图中共有两条曲线X和Y,其中曲线
| A.容器内混合气体的压强不随时间变化而改变 |
| B.容器内混合气体的密度不随时间变化而改变 |
| C.容器内混合气体的颜色不随时间变化而改变 |
| D.容器内混合气体的平均分子量不随时间变化而改变 |
②前 10 min内用NO2表示的化学反应速率v(NO2)=
③反应 25 min 时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网