解答题-实验探究题 0.65 引用1 组卷154
硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]又名摩尔盐,相对分子质量为392,是一种浅绿色晶体,易溶于水,不溶于乙醇,性质比一般亚铁盐稳定,接近100℃时易失去结晶水,是分析化学中的重要试剂.某研究性学习小组用图1所示的实验装置来制取摩尔盐。
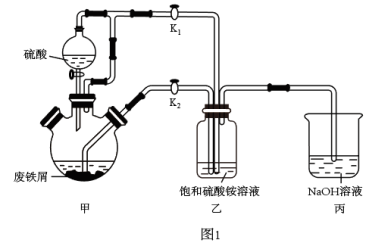
实验步骤如下:
①检查装置的气密性。
②往甲装置中加入过量的废铁屑(含杂质氧化铁和硫化亚铁),其他药品按要求加好。
③关闭止水夹K2、打开K1,打开分液漏斗的旋塞并控制好滴速。
④把三颈烧瓶中的液体转移到装置乙中,当出现大量浅绿色晶体时,关闭分液漏斗的旋塞。
⑤将装置乙中所得晶体抽滤、洗涤和干燥,得到产品。
回答下列问题:
(1)甲装置中加废铁屑的装置名称是:_______ ;
(2)步骤③向装置乙中通入氢气,通入氢气的目的是_______ ;装置丙中NaOH溶液的作用除吸收产生的废气H2S之外,还有_______ 。
(3)通过调节K1、K2的开闭可实现步骤④甲中液体自动转移至装置乙中,具体的实验操作为_______ 。
(4)如图2装置,经过一系列操作完成步骤⑤中的抽滤和洗涤.有关抽滤,下列说法正确的是_______ 。

A.滤纸应比漏斗内径略小,且能盖住所有小孔
B.图2抽滤装置中只有一处错误,即漏斗颈口斜面没有对着吸滤瓶的支管口
C.抽滤得到的滤液应从吸滤瓶的支管口倒出
D.抽滤完毕后,应先拆下连接抽气泵和吸滤瓶的橡皮管,再关水龙头,以防倒吸
(5)测定产品的纯度:称取4.80 g产品,溶于水,配成100.00 mL溶液.移取10.00 mL溶液于锥形瓶中,加水至约100 mL,加4滴二苯胺磺酸钠作指示剂,用0.0100 mol/L重铬酸钾滴定至恰好变为紫色,消耗重铬酸钾20.00 mL,计算产品的纯度_______ .已知滴定过程中发生的反应为:

实验步骤如下:
①检查装置的气密性。
②往甲装置中加入过量的废铁屑(含杂质氧化铁和硫化亚铁),其他药品按要求加好。
③关闭止水夹K2、打开K1,打开分液漏斗的旋塞并控制好滴速。
④把三颈烧瓶中的液体转移到装置乙中,当出现大量浅绿色晶体时,关闭分液漏斗的旋塞。
⑤将装置乙中所得晶体抽滤、洗涤和干燥,得到产品。
回答下列问题:
(1)甲装置中加废铁屑的装置名称是:
(2)步骤③向装置乙中通入氢气,通入氢气的目的是
(3)通过调节K1、K2的开闭可实现步骤④甲中液体自动转移至装置乙中,具体的实验操作为
(4)如图2装置,经过一系列操作完成步骤⑤中的抽滤和洗涤.有关抽滤,下列说法正确的是

A.滤纸应比漏斗内径略小,且能盖住所有小孔
B.图2抽滤装置中只有一处错误,即漏斗颈口斜面没有对着吸滤瓶的支管口
C.抽滤得到的滤液应从吸滤瓶的支管口倒出
D.抽滤完毕后,应先拆下连接抽气泵和吸滤瓶的橡皮管,再关水龙头,以防倒吸
(5)测定产品的纯度:称取4.80 g产品,溶于水,配成100.00 mL溶液.移取10.00 mL溶液于锥形瓶中,加水至约100 mL,加4滴二苯胺磺酸钠作指示剂,用0.0100 mol/L重铬酸钾滴定至恰好变为紫色,消耗重铬酸钾20.00 mL,计算产品的纯度
20-21高二下·浙江绍兴·期末


