解答题-原理综合题 适中0.65 引用2 组卷135
1905年哈伯实现了以氮气和氢气为原料合成氨气,生产的氨制造氮肥服务于农业,养活了地球上三分之一的人口,哈伯也因此获得了1918年的诺贝尔化学奖。一百多年过去了,对合成氨的研究依然没有止步。
(1)工业合成氨的反应如下:N2+3H2 2NH3,已知断裂1molN2中的共价键吸收的能量为946kJ,断裂1molH2中的共价键吸收的能量为436kJ,形成1molN—H键放出的能量为391kJ,则由N2和H2生成2molNH3
2NH3,已知断裂1molN2中的共价键吸收的能量为946kJ,断裂1molH2中的共价键吸收的能量为436kJ,形成1molN—H键放出的能量为391kJ,则由N2和H2生成2molNH3___________ (填“放出”或“吸收”)的能量为___________ kJ。
(2)其他条件相同,在两个体积不变且相同的密闭容器中通入等量的NH3,在两种不同的温度下进行反应,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。
根据上表数据回答:
①反应I从开始到10min,用NH3表示的反应速率为___________ ;
②反应Ⅱ一定达到了平衡状态的时间段为___________ (填字母)
a.10-20min b.20-30min c.30-40min
③反应Ⅱ达到最大限度时NH3的转化率为___________
④实验中T1___________ T2(填“>”“<”或“=”)
⑤下列能说明反应I达到化学平衡状态的是___________ (填字母)。
a.消耗2molNH3的同时生成3molH2
b.混合气体的密度不变
c.容器中的压强不随时间变化
d.N2、H2、NH3的物质的量之比为1∶3∶2
(1)工业合成氨的反应如下:N2+3H2
(2)其他条件相同,在两个体积不变且相同的密闭容器中通入等量的NH3,在两种不同的温度下进行反应,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。
实验序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
I | T1 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
Ⅱ | T2 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上表数据回答:
①反应I从开始到10min,用NH3表示的反应速率为
②反应Ⅱ一定达到了平衡状态的时间段为
a.10-20min b.20-30min c.30-40min
③反应Ⅱ达到最大限度时NH3的转化率为
④实验中T1
⑤下列能说明反应I达到化学平衡状态的是
a.消耗2molNH3的同时生成3molH2
b.混合气体的密度不变
c.容器中的压强不随时间变化
d.N2、H2、NH3的物质的量之比为1∶3∶2
20-21高一下·湖北·阶段练习
类题推荐
1905年哈珀开发实现了以氮气和氢气为原料合成氨气,生产的氨制造氮肥服务于农业,养活了地球三分之一的人口,哈珀也因此获得了1918年的诺贝尔化学奖。
(1)工业合成氨的反应如下:N2+3H2 2NH3。已知断裂1 mol N2中的共价键吸收的能量为946 kJ,断裂1 mol H2中的共价键吸收的能量为436 kJ,形成1 mol N-H键放出的能量为391 kJ,则由N2和H2生成2 mol NH3 的能量变化为
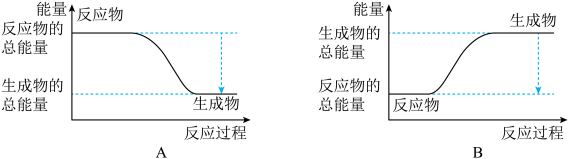
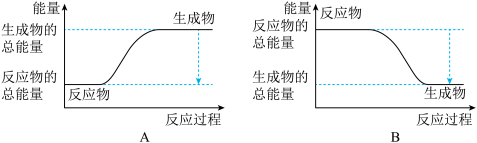
2NH3。已知断裂1 mol N2中的共价键吸收的能量为946 kJ,断裂1 mol H2中的共价键吸收的能量为436 kJ,形成1 mol N-H键放出的能量为391 kJ,则由N2和H2生成2 mol NH3 的能量变化为__________ kJ。 下图能正确表示该反应中能量变化的是__________ (填“A”或“B”)。
(2)反应2NH3(g) N2(g)+3H2(g)在三种不同条件下进行,N2、H2的起始浓度为 0,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。
N2(g)+3H2(g)在三种不同条件下进行,N2、H2的起始浓度为 0,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。
根据上述数据回答:实验①②中,有一个实验使用了催化剂,它是实验_____ (填序号);实验①③对比说明了_________________________________ 。在恒温恒容条件下,判断该反应达到化学平衡状态的标志是_________ (填序号)。
a. NH3的正反应速率等于逆反应速率 b.混合气体的密度不变
c.混合气体的压强不变 d.c(NH3)=c(H2)
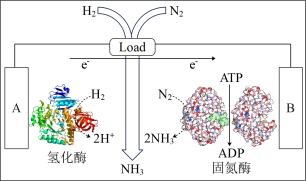
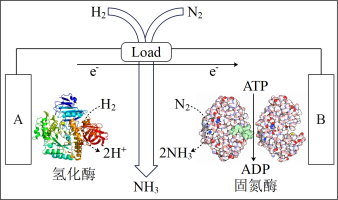
(3)近日美国犹他大学 Minteer教授成功构筑了H2—N2生物燃料电池。该电池类似燃料电池原理,以氮气和氢气为原料、氢化酶和固氮酶为两极催化剂、质子交换膜(能够传递H+)为隔膜,在室温条件下即实现了氨的合成同时还能提供电能。则A电极为_____ 极(填“正”、“负”),该电池放电时溶液中的H+向______ 极移动(填“A”、“B”)。
(1)工业合成氨的反应如下:N2+3H2

(2)反应2NH3(g)
| 实验序号 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| ① | 400℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| ② | 400℃ | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| ③ | 500℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
a. NH3的正反应速率等于逆反应速率 b.混合气体的密度不变
c.混合气体的压强不变 d.c(NH3)=c(H2)
(3)近日美国犹他大学 Minteer教授成功构筑了H2—N2生物燃料电池。该电池类似燃料电池原理,以氮气和氢气为原料、氢化酶和固氮酶为两极催化剂、质子交换膜(能够传递H+)为隔膜,在室温条件下即实现了氨的合成同时还能提供电能。则A电极为

1905年哈伯实现了以氮气和氢气为原料合成氨气,生产的氨制造氮肥服务于农业,养活了地球三分之一的人口,哈伯也因此获得了1918年的诺贝尔化学奖。一百多年过去了,对合成氨的研究依然没有止步。
(1)已知在一定温度下进行的化学反应,反应所释放或吸收的能量称为该温度下的反应热。反应热用符号△H表示;△H =反应物断键吸收总能量-生成物成键放出总能量,若△H<0为放热反应,△H>0为吸热反应。如H2和O2反应: 放热,且断开1 mol H-H键、1mol O=O键、1 molO-H键需吸收的能量分别为
放热,且断开1 mol H-H键、1mol O=O键、1 molO-H键需吸收的能量分别为 、
、 、
、 ,可推知△H数值
,可推知△H数值 ,则反应中能量变化为
,则反应中能量变化为 。对工业合成氨的反应如下:
。对工业合成氨的反应如下: ,已知断裂1 mol N2中的共价键吸收的能量为947 kJ,断裂1 mol H2中的共价键吸收的能量为436 kJ,形成1 mol N-H键放出的能量为391 kJ,则由N2(g)和H2 (g)生成1 mol NH3(g)的能量变化为
,已知断裂1 mol N2中的共价键吸收的能量为947 kJ,断裂1 mol H2中的共价键吸收的能量为436 kJ,形成1 mol N-H键放出的能量为391 kJ,则由N2(g)和H2 (g)生成1 mol NH3(g)的能量变化为_______ kJ;下图能正确表示该反应中能量变化的是_________ (填“A”或“B”)。
(2)反应 在三种不同条件下进行,N2、N2的起始浓度为0,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。
在三种不同条件下进行,N2、N2的起始浓度为0,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。
根据上表数据回答:实验①②中,有一个实验使用了催化剂,它是实验_______ (填序号);实验③达平衡时NH3的转化率为_______ 。在恒温恒容条件下,判断该反应达到化学平衡状态的标志是_______ (填字母)。
a.NH3的正反应速率等于逆反应速率 b.混合气体的密度不变
c.混合气体的压强不变 d.c(NH3)=c(H2)
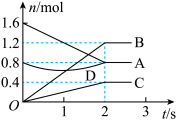
(3)某温度下,在体积为3 L的容器中,A、B、C三种气体物质物质的量随着时间变化的关系如图所示,则①该反应的化学方程式为_______ ,②反应开始至2 s时,B的平均反应速率为_______ 。
(4)氢气是未来最理想的能源。科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用下使海水分解得到氢气的新技术: ,制得的氢气可用于制作燃料电池。试回答下列问题:
,制得的氢气可用于制作燃料电池。试回答下列问题:
①某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,A极上发生的电极反应为 ,则A极是电池的
,则A极是电池的_______ 极。
②一种人工合成汽油的方法是先将煤制成CO和H2,然后在一定条件下将CO与H2转化为碳原子数为5~8的烷烃(人工合成汽油)。若以CnH2n+2表示人工合成汽油的成分,请写出用CO与H2制取CnH2n+2的化学方程式_______ 。
(1)已知在一定温度下进行的化学反应,反应所释放或吸收的能量称为该温度下的反应热。反应热用符号△H表示;△H =反应物断键吸收总能量-生成物成键放出总能量,若△H<0为放热反应,△H>0为吸热反应。如H2和O2反应:

(2)反应
| 实验序号 | 时间浓度温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| ① | 400℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| ② | 400℃ | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| ③ | 500℃ | 1.0 | 0.40 | 0.25 | 0.15 | 0.15 | 0.15 | 0.15 |
a.NH3的正反应速率等于逆反应速率 b.混合气体的密度不变
c.混合气体的压强不变 d.c(NH3)=c(H2)
(3)某温度下,在体积为3 L的容器中,A、B、C三种气体物质物质的量随着时间变化的关系如图所示,则①该反应的化学方程式为

(4)氢气是未来最理想的能源。科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用下使海水分解得到氢气的新技术:
①某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,A极上发生的电极反应为
②一种人工合成汽油的方法是先将煤制成CO和H2,然后在一定条件下将CO与H2转化为碳原子数为5~8的烷烃(人工合成汽油)。若以CnH2n+2表示人工合成汽油的成分,请写出用CO与H2制取CnH2n+2的化学方程式
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网