解答题-原理综合题 较难0.4 引用1 组卷363
CH4—CO2重整反应[CH4(g)+CO2(g)=2CO(g)+2H2(g) △H>0]在大力推进生态文明建设、“碳达峰”、“碳中和”的时代背景下,受到更为广泛的关注。
(1)相关物质的燃烧热数据如下表所示:
ΔH=_______ kJ·mol-1。
(2)该反应以两种温室气体为原料,可以生成合成气。如何减少反应过程中的催化剂积炭,是研究的热点之一、某条件下,发生主反应的同时,还发生了积炭反应:
CO歧化:2CO(g)=CO2(g)+C(s) △H=-172kJ/mol
CH4裂解:CH4(g)=C(s)+2H2(g) △H=+75kJ/mol
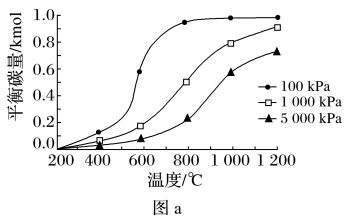
①对积炭反应进行计算,得到温度和压强对积炭反应中平衡炭量的影响图(图a和图b),其中表示温度和压强对CH4的裂解反应中平衡炭量影响的是(选填序号)_______ ,理由是_______ 。
②实验表明,在重整反应中,低温、高压时会有显著积炭产生,由此可推断,对于该重整反应而言,其积炭主要由_______ 反应产生。
综合以上分析,为抑制积炭产生,应选用高温、低压条件。
(3)该重整反应也可用于太阳能、核能、高温废热等的储存,储能研究是另一研究热点。
①该反应可以储能的原因是_______ 。
②某条件下,研究者研究反应物气体流量、物质的量比( )对CH4转化率(XCH4)、储能效率的影响,部分数据如下所示。
)对CH4转化率(XCH4)、储能效率的影响,部分数据如下所示。
(资料)储能效率:热能转化为化学能的效率,用ηchem表示。ηchem= 。其中,Qchem是通过化学反应吸收的热量,Q是设备的加热功率。
。其中,Qchem是通过化学反应吸收的热量,Q是设备的加热功率。
a.对比实验_______ (填序号),可得出结论:气体流量越大,CH4转化率越低。
b.对比实验②和③发现,混合气中CO2占比越低,储能效率越高,原因可能是_______ (该条件下设备的加热功率Q视为不变)。
(1)相关物质的燃烧热数据如下表所示:
| 物质 | CH4(g) | CO(g) | H2(g) |
| 燃烧热(kJ·mol-1) | 890.3 | 283.0 | 285.8 |
(2)该反应以两种温室气体为原料,可以生成合成气。如何减少反应过程中的催化剂积炭,是研究的热点之一、某条件下,发生主反应的同时,还发生了积炭反应:
CO歧化:2CO(g)=CO2(g)+C(s) △H=-172kJ/mol
CH4裂解:CH4(g)=C(s)+2H2(g) △H=+75kJ/mol
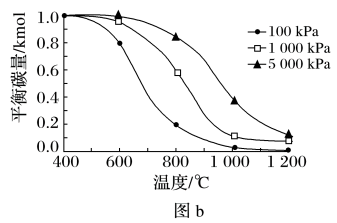
①对积炭反应进行计算,得到温度和压强对积炭反应中平衡炭量的影响图(图a和图b),其中表示温度和压强对CH4的裂解反应中平衡炭量影响的是(选填序号)

②实验表明,在重整反应中,低温、高压时会有显著积炭产生,由此可推断,对于该重整反应而言,其积炭主要由
综合以上分析,为抑制积炭产生,应选用高温、低压条件。
(3)该重整反应也可用于太阳能、核能、高温废热等的储存,储能研究是另一研究热点。
①该反应可以储能的原因是
②某条件下,研究者研究反应物气体流量、物质的量比(
| 序号 | 加热温度/℃ | 反应物气体流量/L·min-1 | XCH4/% | ηchem/% | |
| ① | 800 | 4 | 2:2 | 79.6 | 52.2 |
| ② | 800 | 6 | 3:3 | 64.2 | 61.9 |
| ③ | 800 | 6 | 2:4 | 81.1 | 41.6 |
a.对比实验
b.对比实验②和③发现,混合气中CO2占比越低,储能效率越高,原因可能是
2021·湖南长沙·三模
类题推荐  重整反应【
重整反应【
 】可以生成合成气。如何减少反应过程中的积炭,是研究的热点之一、某条件下,发生主反应的同时,还发生了积炭反应:
】可以生成合成气。如何减少反应过程中的积炭,是研究的热点之一、某条件下,发生主反应的同时,还发生了积炭反应:
 歧化:
歧化:

 裂解:
裂解:

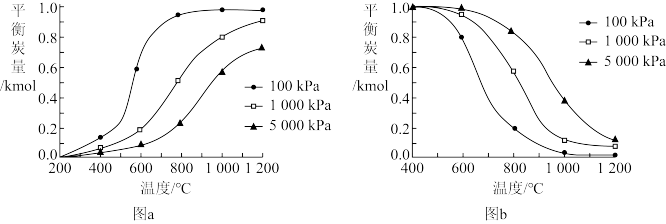
(1)对上述两个积炭反应分别进行计算,得到以下温度和压强对积炭反应中平衡炭量的影响图,其中表示温度和压强对 裂解反应中平衡炭量影响的是
裂解反应中平衡炭量影响的是___________ (填“图a”或“图b”),
___________ 0(填“>”或“<”),___________ (填“高温”或“低温”)有利于 歧化反应自发进行。
歧化反应自发进行。
(2)实验表明,在重整反应中,为抑制积炭产生,应选用高温、低压条件,由此可推断,该重整反应过程中的积炭主要由___________ 反应产生。
(3)一定条件下, 裂解的反应历程如图所示。该历程分
裂解的反应历程如图所示。该历程分___________ 步进行,其中决定 裂解反应快慢的基元反应
裂解反应快慢的基元反应___________ (写出化学方程式)。

(4)同温下,某研究小组分别在容积相等的两个恒容密闭容器中加入一定量的反应物,控制反应条件使其仅发生 重整反应,获得如下效据:
重整反应,获得如下效据:
①容器ⅰ中反应达到平衡时,生成 的物质的量为
的物质的量为___________ ,容器ⅱ中反应达到平衡状态过程中吸收的热量___________ ,247kJ(填“>”、“<”或“=”)。
②容器ⅰ的容积变为原来的一半,则 平衡转化率
平衡转化率___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
③计算容器ⅱ中反应的平衡常数
___________  (用平衡分压代替平衡浓度计算,分压
(用平衡分压代替平衡浓度计算,分压 总压
总压 物质的量分数)。
物质的量分数)。
CH4-CO2重整反应[CH4(g)+CO2(g) 2CO(g)+2H2(g)-Q(Q>0)]以两种温室气体为原料生成了合成气,在“碳中和”的时代背景下,该技术受到更为广泛的关注。
2CO(g)+2H2(g)-Q(Q>0)]以两种温室气体为原料生成了合成气,在“碳中和”的时代背景下,该技术受到更为广泛的关注。
Ⅰ.完成下列填空:
(1)某温度下,在体积2L的容器中加入2molCH4、1molCO2以及催化剂进行重整反应,经过2min达到平衡状态时CO2的转化率为50%。此过程中以CH4表示的平均化学反应速率为_______ 。平衡常数的值为_______ 。达到平衡后,其他条件不变时向容器中充入CO2与CO各1mol,则化学平衡_______ 移动(选填“正向”“逆向”或“不”)。
Ⅱ.储能是指通过介质或设备把能量存储起来,在需要时再释放的过程。CH4-CO2重整反应也可用于高温废热的储能。800℃下,研究反应物气体流量、CH4与CO2物质的量比对CH4转化率(α)、储能效率(η)的影响,部分数据如下所示。
已知储能效率η=Qchem/Qi,其中,Qchem是通过化学反应吸收的热量,Qi是设备的加热功率。
(2)解释为何可以用CH4-CO2重整反应进行储能。_______
(3)对比实验_______ (填序号),可得出结论:气体流量越大,CH4转化率_______ 。
(4)实验ⅳ中CH4转化率比实验ⅲ高,结合相关数据解释为何储能效率却低的原因(两次实验中设备的加热功率Qi不变)。_______
Ⅰ.完成下列填空:
(1)某温度下,在体积2L的容器中加入2molCH4、1molCO2以及催化剂进行重整反应,经过2min达到平衡状态时CO2的转化率为50%。此过程中以CH4表示的平均化学反应速率为
Ⅱ.储能是指通过介质或设备把能量存储起来,在需要时再释放的过程。CH4-CO2重整反应也可用于高温废热的储能。800℃下,研究反应物气体流量、CH4与CO2物质的量比对CH4转化率(α)、储能效率(η)的影响,部分数据如下所示。
| 序号 | 加热温度/℃ | 反应物气体流量/L•min-1 | n(CH4)∶n(CO2) | α/% | η/% |
| ⅰ | 700 | 4 | 2∶2 | 49.0 | 42.0 |
| ⅱ | 800 | 4 | 2∶2 | 79.6 | 52.2 |
| ⅲ | 800 | 6 | 3∶3 | 64.2 | 61.9 |
| ⅳ | 800 | 6 | 2∶4 | 81.1 | 41.6 |
(2)解释为何可以用CH4-CO2重整反应进行储能。
(3)对比实验
(4)实验ⅳ中CH4转化率比实验ⅲ高,结合相关数据解释为何储能效率却低的原因(两次实验中设备的加热功率Qi不变)。

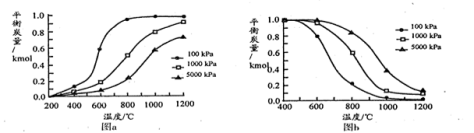
(1)对上述两个积炭反应分别进行计算,得到以下温度和压强对积炭反应中平衡炭量的影响图,其中表示温度和压强对
(2)实验表明,在重整反应中,为抑制积炭产生,应选用高温、低压条件,由此可推断,该重整反应过程中的积炭主要由
(3)一定条件下,

(4)同温下,某研究小组分别在容积相等的两个恒容密闭容器中加入一定量的反应物,控制反应条件使其仅发生
| 容器编号 | 起始时各物质的物质的量/mol | 达到平衡时体系的压强/MPa | 达到平衡时体系能量的变化 | ||||
| ⅰ | 1 | 2 | 0 | 0 | P | 吸收热量:123.5kJ | |
| ⅱ | 2 | 4 | 0 | 0 | |||
②容器ⅰ的容积变为原来的一半,则
③计算容器ⅱ中反应的平衡常数
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网