解答题-结构与性质 适中0.65 引用1 组卷122
铜,硫单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
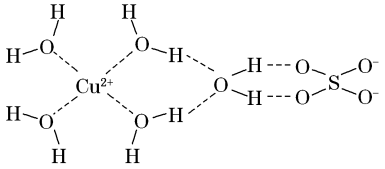
(1)科学家通过X射线测得胆矾结构示意图可简单表示如图:
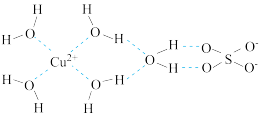
图中虚线表示的作用力为_______ ;Cu2+的核外电子排布式是:_______ ;该结构中氢,氧,硫这三种元素电负性由大到小的顺序:_______ (用元素符号表示)
(2)SO2分子的立体结构是_______ ,相同条件下SO2与CO2分子在水中的溶解度较大的是_______ (写分子式),理由是_______ 。
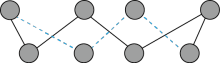
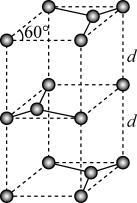
(3)第一电离能介于B、N之间的第二周期元素有_______ 种。S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是_______
(4)①金刚石、②晶体硅、③碳化硅,三者熔点由低到高的顺序是_______ (填序号),原因是_______ 。
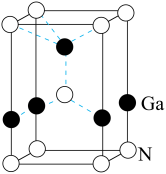
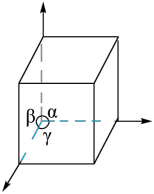
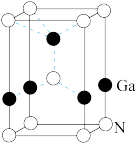
(5)GaN被誉为21世纪引领5G 时代的基石材料,是目前全球半导体研究的前沿和热点。有一种氮化镓的六方晶胞结构如图所示,其晶胞参数为:α=β=90°,γ=120°。已知:该晶体的密度为ρg/cm3,晶胞底边边长为a cm,高为b cm,则阿伏加德罗常数为_______ mol-1(用含a、b、ρ的代数式表示)。
(1)科学家通过X射线测得胆矾结构示意图可简单表示如图:

图中虚线表示的作用力为
(2)SO2分子的立体结构是
(3)第一电离能介于B、N之间的第二周期元素有

(4)①金刚石、②晶体硅、③碳化硅,三者熔点由低到高的顺序是
(5)GaN被誉为21世纪引领5G 时代的基石材料,是目前全球半导体研究的前沿和热点。有一种氮化镓的六方晶胞结构如图所示,其晶胞参数为:α=β=90°,γ=120°。已知:该晶体的密度为ρg/cm3,晶胞底边边长为a cm,高为b cm,则阿伏加德罗常数为


20-21高二下·四川达州·阶段练习
类题推荐
碳、磷、硫等元素形成的单质和化合物在生活、生产中有重要的用途。
(1)下列氮原子的电子排布图表示的状态中,能量由低到高的顺序是___ (填字母)。
A.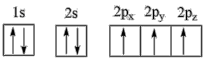 B.
B.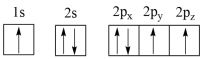
C.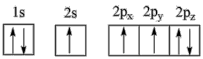 D.
D.
(2)P4S3可用于制造火柴,其分子结构如图所示:

①P4S3分子中硫原子的杂化轨道类型为___ 。
②1molP4S3分子中含有的孤电子对的数目为___ 对。
(3)科学家合成了一种阳离子“N5n+”,其结构是对称的,5个N排成“V”形,每个N都达到8电子稳定结构,且含有2个氮氮三键,此后又合成了一种含有“N5n+”的化学式为“N8”的离子晶体(该晶体中每个N原子都达到了8电子稳定结构),N8的电子式为___ 。(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子的最外层均满足8电子稳定结构,其结构式为___ 。
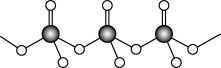
(4)直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,其结构如图所示。则由n个磷氧四面体形成的这类磷酸根离子的通式为___ 。
(5)碳酸盐中的阳离子不同,热分解温度就不同。下表为四种碳酸盐的热分解温度和对应金属阳离子的半径。随着金属阳离子半径的增大,碳酸盐的热分解温度逐渐升高,原因是___ 。
(6)石墨的晶胞结构如图所示。已知石墨的密度为ρg·cm-3,C-C键的键长为rcm,NA为阿伏加 德罗常数的值,则石墨晶体的层间距d=___ cm。
(1)下列氮原子的电子排布图表示的状态中,能量由低到高的顺序是
A.
 B.
B.
C.
 D.
D.
(2)P4S3可用于制造火柴,其分子结构如图所示:

①P4S3分子中硫原子的杂化轨道类型为
②1molP4S3分子中含有的孤电子对的数目为
(3)科学家合成了一种阳离子“N5n+”,其结构是对称的,5个N排成“V”形,每个N都达到8电子稳定结构,且含有2个氮氮三键,此后又合成了一种含有“N5n+”的化学式为“N8”的离子晶体(该晶体中每个N原子都达到了8电子稳定结构),N8的电子式为
(4)直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,其结构如图所示。则由n个磷氧四面体形成的这类磷酸根离子的通式为

(5)碳酸盐中的阳离子不同,热分解温度就不同。下表为四种碳酸盐的热分解温度和对应金属阳离子的半径。随着金属阳离子半径的增大,碳酸盐的热分解温度逐渐升高,原因是
| 碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
| 热分解温度/℃ | 402 | 900 | 1172 | 1360 |
| 金属阳离子半径/pm | 66 | 99 | 112 | 135 |

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
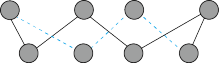 ,S原子采用的轨道杂化方式是
,S原子采用的轨道杂化方式是