解答题-原理综合题 适中0.65 引用1 组卷222
I.(1)甲醇既是重要的化工原料,又可作为燃料。已知:
计算 和
和 生成
生成 的反应热
的反应热
_______ 。
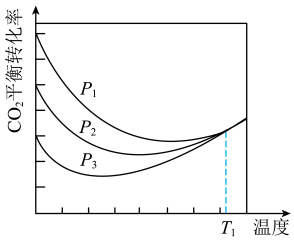
(2)压强为 时,向体积为1L的密闭容器中充入
时,向体积为1L的密闭容器中充入
 和
和
 ,发生反应
,发生反应 。平衡时
。平衡时 的转化率与温度、压强的关系如下图所示。
的转化率与温度、压强的关系如下图所示。
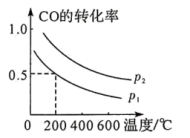
请回答下列问题:
①该反应
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②200℃时,该反应的平衡常数
_______ 。
II.草酸 是二元弱酸。向
是二元弱酸。向

 溶液中加入
溶液中加入
 溶液调节
溶液调节 。加水控制溶液体积为
。加水控制溶液体积为 。测得溶液中微粒的
。测得溶液中微粒的 随
随 的变化曲线如下图所示,其中
的变化曲线如下图所示,其中 ,
, 代表微粒
代表微粒 、
、 或
或 。
。
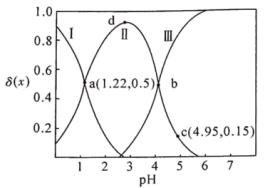
(1)曲线Ⅲ代表_______ 的变化曲线。
(2)c点溶液中
_______ 。
(3)d点溶液中各离子浓度从大到小的顺序为_______ 。
| 化学键 | C O O | ||||
| 436 | 343 | 1076 | 465 | 413 |
(2)压强为

请回答下列问题:
①该反应
②200℃时,该反应的平衡常数
II.草酸

(1)曲线Ⅲ代表
(2)c点溶液中
(3)d点溶液中各离子浓度从大到小的顺序为
20-21高二下·河南·期中
类题推荐
碳及其化合物在能源、材料等方面具有广泛的用途。回答下列问题:
(1)碳酸和草酸均为二元弱酸,其电离分为两步进行,已知其电离常数的有关数据如下表:向Na2CO3溶液中滴加草酸溶液,开始时所发生反应的离子方程式为 。
(2)常温时,C和CO的燃烧热△H分别为-394.0 kJ·mol-1、-283.0 kJ·mol-1,该条件下C转化为CO的热化学方程式为 。
(3)氢气和一氧化碳在一定条件下可合成甲醇,反应如下
2H2(g)+CO(g) CH3OH(g) △H=Q kJ·mol-1。
CH3OH(g) △H=Q kJ·mol-1。
①该反应在不同温度下的化学平衡常数(K)如下表:
由此可判断Q 0(填“>”、“=”或“<”)
②一定温度下,将6 mol H2和2mol CO充入到体积为2 L的密闭容器中,10 min时反应达到平衡状态,此时测得c(CO)=0.2 mol·L-1,该温度下的平衡常数K= 。0~10 min内,反应速率v(CH3OH)= 。
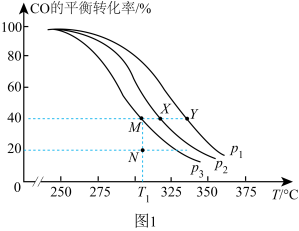
③在两个密闭容器中分别都充入20 mol H2和10 mol CO,测得一氧化碳的平衡转化率随温度(T)、压强(p)的变化如下图所示:
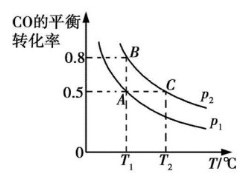
A、B两点压强大小关系:p1 p2(填“>”、“=”或“<”)。若A点对应容器的容积为20 L,则B点对应的容器的容积为 L。
(1)碳酸和草酸均为二元弱酸,其电离分为两步进行,已知其电离常数的有关数据如下表:向Na2CO3溶液中滴加草酸溶液,开始时所发生反应的离子方程式为 。
| H2CO3 | H2C2O4 | |
| K1 | 4.2×10-7 | 5.4×10-2 |
| K2 | 5.6×10-11 | 5.4×10-5 |
(2)常温时,C和CO的燃烧热△H分别为-394.0 kJ·mol-1、-283.0 kJ·mol-1,该条件下C转化为CO的热化学方程式为 。
(3)氢气和一氧化碳在一定条件下可合成甲醇,反应如下
2H2(g)+CO(g)
 CH3OH(g) △H=Q kJ·mol-1。
CH3OH(g) △H=Q kJ·mol-1。①该反应在不同温度下的化学平衡常数(K)如下表:
| 温度(℃) | 250 | 300 | 350 |
| K(L2·mol-1) | 2.041 | 0.270 | 0.012 |
由此可判断Q 0(填“>”、“=”或“<”)
②一定温度下,将6 mol H2和2mol CO充入到体积为2 L的密闭容器中,10 min时反应达到平衡状态,此时测得c(CO)=0.2 mol·L-1,该温度下的平衡常数K= 。0~10 min内,反应速率v(CH3OH)= 。
③在两个密闭容器中分别都充入20 mol H2和10 mol CO,测得一氧化碳的平衡转化率随温度(T)、压强(p)的变化如下图所示:

A、B两点压强大小关系:p1 p2(填“>”、“=”或“<”)。若A点对应容器的容积为20 L,则B点对应的容器的容积为 L。
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网