解答题-原理综合题 较难0.4 引用1 组卷219
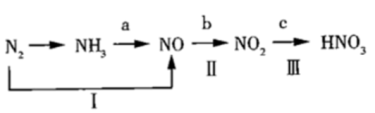
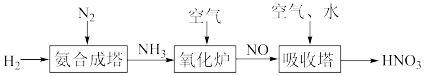
Ⅰ.氨是工业生产硝酸的重要原料,请根据以下工业制硝酸的原理示意图回答含氮化合物相关的问题:

(1)工业用甲烷制取氢气作为合成氨的原料,已知以下的热化学反应方程式:
①2CO(g)+O2(g)=2CO2(g)∆H=-566kJ/mol
②2H2(g)+O2(g)=2H2O(g)∆H=-484kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(g)∆H=-890kJ/mol
则:CH4(g)+CO2(g)=2CO(g)+2H2(g)∆H=__ kJ/mol。
(2)一定温度下,将N2与H2以体积比1:2置于2L的密闭容器中发生反应:N2(g)+3H2(g) 2NH3(g),下列能说明反应达到平衡状态的是
2NH3(g),下列能说明反应达到平衡状态的是___ 。
A.体系压强保持不变
B.混合气体颜色保持不变
C.N2与H2的物质的量之比保持不变
D.每消耗2molNH3的同时消耗1molN2
(3)“吸收塔”尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的破坏作用,通常用氨转化法处理:已知7mol氨恰好能将含NO和NO2共6mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为__ 。
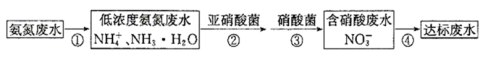
Ⅱ.氮肥厂的废水直接排放会造成污染,目前氨氮废水处理方法主要有吹脱法、化学沉淀法、生物硝化反硝化法等。某氮肥厂的氨氮废水中氮元素多以NH 和NH3•H2O的形式存在。该厂技术团队设计该废水处理方案流程如图:
和NH3•H2O的形式存在。该厂技术团队设计该废水处理方案流程如图:
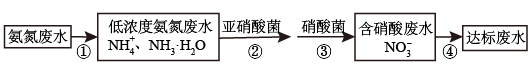
(4)检验某溶液中是否含有NH 的方法
的方法___ (写出所需试剂、操作及现象)。
(5)过程②、③:在微生物亚硝酸菌和硝酸菌作用下实现NH →NO
→NO →NO
→NO 的转化,称为硝化反应。1molNH
的转化,称为硝化反应。1molNH 可被
可被___ L(标准状况)O2最终氧化成NO 。
。
(6)过程④:在一定条件下向废水中加入甲醇(CH3OH)实现HNO2→N2转化,称为反硝化反应。此过程中甲醇(C元素-2价)转化为CO2,写出此过程的化学方程式___ 。

(1)工业用甲烷制取氢气作为合成氨的原料,已知以下的热化学反应方程式:
①2CO(g)+O2(g)=2CO2(g)∆H=-566kJ/mol
②2H2(g)+O2(g)=2H2O(g)∆H=-484kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(g)∆H=-890kJ/mol
则:CH4(g)+CO2(g)=2CO(g)+2H2(g)∆H=
(2)一定温度下,将N2与H2以体积比1:2置于2L的密闭容器中发生反应:N2(g)+3H2(g)
A.体系压强保持不变
B.混合气体颜色保持不变
C.N2与H2的物质的量之比保持不变
D.每消耗2molNH3的同时消耗1molN2
(3)“吸收塔”尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的破坏作用,通常用氨转化法处理:已知7mol氨恰好能将含NO和NO2共6mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为
Ⅱ.氮肥厂的废水直接排放会造成污染,目前氨氮废水处理方法主要有吹脱法、化学沉淀法、生物硝化反硝化法等。某氮肥厂的氨氮废水中氮元素多以NH

(4)检验某溶液中是否含有NH
(5)过程②、③:在微生物亚硝酸菌和硝酸菌作用下实现NH
(6)过程④:在一定条件下向废水中加入甲醇(CH3OH)实现HNO2→N2转化,称为反硝化反应。此过程中甲醇(C元素-2价)转化为CO2,写出此过程的化学方程式
20-21高一下·河北沧州·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网